Gráficamente abstracto. Crédito: Celúla (2022). DOI: 10.1016/j.cell.2022.03.023
Las terapias basadas en células inmunitarias modificadas han surgido recientemente como un enfoque prometedor en el tratamiento del cáncer. En comparación con los medicamentos tradicionales, las células inmunitarias diseñadas son más precisas y sofisticadas en su capacidad para detectar y eliminar las células cancerosas.
Pero a pesar de su promesa, las terapias basadas en células aún enfrentan limitaciones importantes, incluida la toxicidad y la posibilidad de que puedan atacar las células sanas. Además, los científicos no saben cómo modificar las células terapéuticas existentes para ampliar sus aplicaciones o controlar mejor su actividad.
Para superar estas limitaciones, los investigadores de Gladstone Institutes y UC San Francisco (UCSF) llevaron a cabo un análisis sistemático de los componentes básicos moleculares utilizados para diseñar células terapéuticas. Su trabajo, publicado en la revista Celúlaresultó en un libro de reglas integral para el diseño de células terapéuticas con especificidad y seguridad mejoradas, y para la eventual personalización de terapias basadas en células.
«Hemos identificado principios que deberían facilitar en gran medida la ingeniería de células terapéuticas con mayor sensibilidad, precisión y seguridad de lo que era posible antes», dice Kole Roybal, Ph.D., profesor asociado en el Departamento de Microbiología e Inmunología de la UCSF, investigador afiliado de Gladstone Institutes y miembro principal del Gladstone-UCSF Institute of Genomic Immunology, investigador del Parker Institute for Cancer Immunotherapy y autor principal del estudio. «Nuestro trabajo proporcionará a los investigadores biomédicos un conjunto de herramientas para dirigir una gama de terapias basadas en células a sus objetivos previstos y para programar sus actividades terapéuticas».
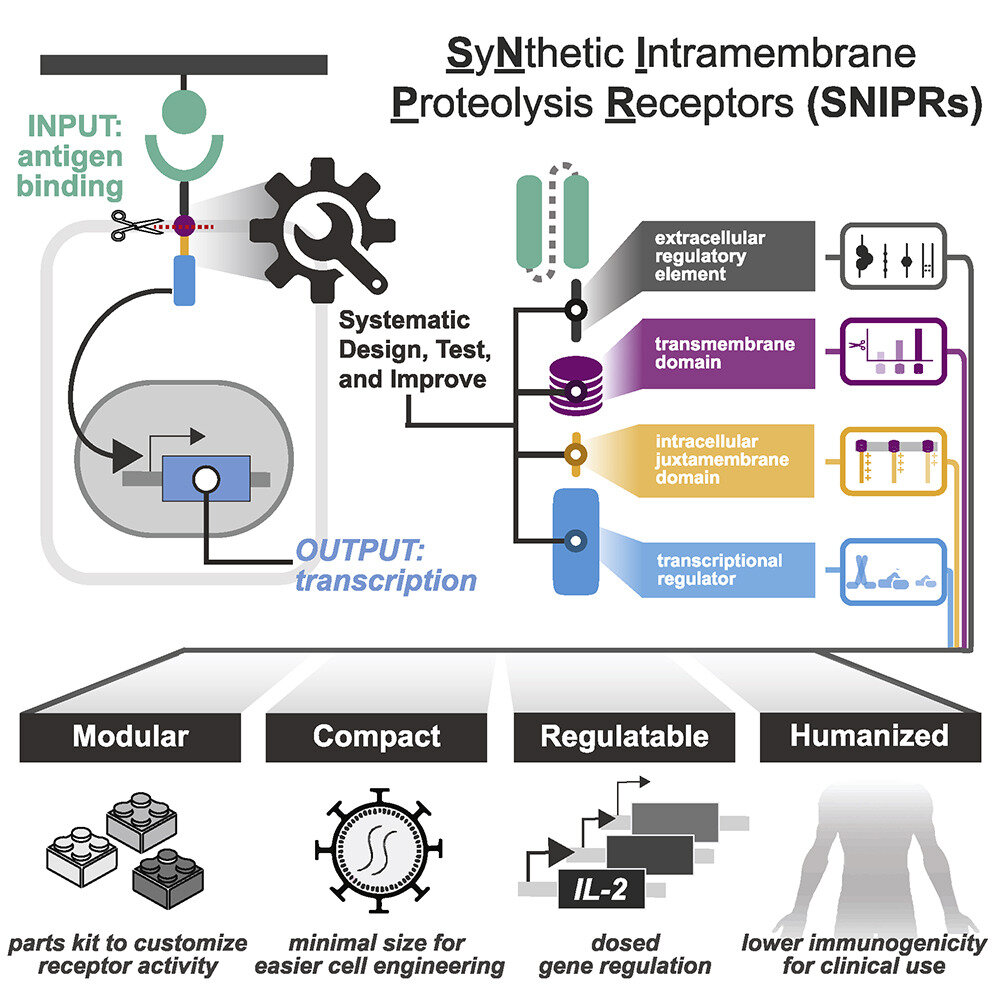
Construyendo un mejor receptor
En el núcleo de la mayoría de las células terapéuticas hay una molécula llamada receptor. Los receptores son proteínas grandes que se extienden a ambos lados de la membrana externa de la célula. Su porción externa reconoce un objetivo específico (por ejemplo, una proteína en la superficie de una célula cancerosa) y su porción interna le dice a la célula qué hacer al reconocer este objetivo. Una forma de diseñar una célula terapéutica es insertar en una célula, a menudo una célula inmunitaria llamada célula T, un receptor sintético hecho al juntar fragmentos de receptores conocidos.
Este enfoque se utilizó para crear células CAR-T, que han demostrado ser muy eficaces para eliminar algunos tipos de cánceres de la sangre. Las células CAR-T albergan un «receptor de antígeno quimérico» (CAR) que se basa en un receptor que normalmente se encuentra en las células T.
Comenzando con una columna vertebral diferente, Roybal desarrolló previamente un receptor llamado synNotch que puede dirigir a las células T para que reconozcan y eliminen mejor los tumores sólidos. Desde esta etapa inicial de investigación, el laboratorio de Roybal ha demostrado cómo se puede usar synNotch en combinación con CAR para desarrollar terapias celulares de próxima generación para el cáncer de ovario y el mesotelioma. El receptor synNotch permite a los científicos controlar con precisión cuándo y dónde está activa la célula T terapéutica.
«Estas terapias de células inteligentes pueden desencadenar una potente actividad terapéutica precisamente en el sitio de la enfermedad, mejorando la eficacia de la terapia y reduciendo la posibilidad de toxicidades potencialmente mortales observadas en los pacientes», dice Roybal.
Sin embargo, el receptor synNotch original es difícil de implementar para la terapia basada en células en humanos. Por un lado, es voluminoso, lo que dificulta su inserción en células humanas. Por otro lado, algunas de sus partes provienen de ratones, levaduras y virus en lugar de receptores humanos, lo que podría conducir al rechazo inmunológico de las células modificadas una vez que se introducen en un paciente.
Para comprender qué podían conservar y eliminar del receptor synNotch sin perder sus características deseables, el equipo de Roybal intercambió sistemáticamente varias partes del receptor. Después de insertar los receptores modificados en las células T humanas, los científicos probaron su capacidad para reconocer sus objetivos previstos y activar la respuesta esperada.
«Una hazaña desafiante pero divertida fue averiguar cómo funcionan las diferentes partes de los receptores conocidos, de modo que pudiéramos separar esas piezas y volver a unirlas de formas novedosas para cumplir con nuestras especificaciones de diseño», dice Raymond Liu, Ph.D., un primer autor del estudio y becario postdoctoral en el laboratorio de Roybal.
Al final, el equipo produjo un catálogo de receptores que llamaron SNIPR, que son lo suficientemente pequeños para la ingeniería rentable en células humanas. También están hechos exclusivamente de fragmentos de receptores humanos y pueden detectar y responder incluso a pequeñas cantidades de sus objetivos. Además, la actividad de los SNIPR se puede adaptar para que las células que los albergan no solo eliminen las células diana, sino que también puedan enviar moléculas específicas a lugares precisos de la enfermedad.
«Comprender las reglas del diseño de receptores nos permitió construir receptores que son más efectivos y también más adecuados para la traducción clínica», dice Iowis Zhu, estudiante graduado en Roybal Lab y el otro primer autor del nuevo estudio.
Una plataforma para la terapia celular de última generación
A continuación, los investigadores evaluaron la capacidad de estos receptores optimizados para eliminar tumores en modelos de leucemia, mesotelioma y cáncer de ovario en ratones.
Para reducir las posibilidades de matar células no diana, combinaron un SNIPR diseñado para reconocer una molécula en el tumor con un receptor CAR sintonizado con otra molécula tumoral. Además, hicieron que la producción del receptor CAR dependiera de la activación del receptor SNIPR. De esta manera, solo se matarían las células que portaban los objetivos de los receptores synNotch y CAR, mientras que las células que portaban solo un objetivo no lo harían.
En cada uno de los tres tipos de cáncer que probaron, esta estrategia de focalización de dos pasos condujo a una eliminación más selectiva de las células cancerosas de lo que podría lograrse con cualquiera de los receptores solos, lo que destaca la promesa de este enfoque para reducir la toxicidad fuera del objetivo de las terapias celulares.
Las terapias celulares basadas en SNIPR ahora se están optimizando para el tratamiento del cáncer de ovario, cáncer renal, cáncer de próstata y glioblastoma tanto en el entorno académico como en una empresa llamada Arsenal Bio, cofundada por Roybal.
Y es posible que el cáncer no sea la única afección que podría tratarse con la terapia celular basada en SNIPR.
Este sistema receptor también puede mejorar la actividad antiinflamatoria de las células inmunitarias para el tratamiento de la autoinmunidad. Además, los SNIPR podrían usarse para atacar células madre u otros tipos de células para detectar daño tisular e inducir la reparación tisular o la reversión de la fibrosis.
«Las células diseñadas tienen el potencial de funcionar como terapias mucho más inteligentes que las moléculas pequeñas y los productos biológicos tradicionales», dice Roybal. «Esperamos que nuestro nuevo sistema receptor sirva como una plataforma tecnológica que permita a los científicos y médicos diseñar terapias basadas en células más seguras, dirigidas y más efectivas contra el cáncer y muchas otras enfermedades».
Las modificaciones de la terapia CAR-T ofrecen una nueva promesa para las inmunoterapias contra el cáncer
Iowis Zhu et al, Diseño modular de receptores sintéticos para la regulación génica programada en terapias celulares, Celúla (2022). DOI: 10.1016/j.cell.2022.03.023
Citación: Un nuevo kit de herramientas para diseñar células terapéuticas seguras y eficientes (15 de abril de 2022) consultado el 16 de abril de 2022 en https://medicalxpress.com/news/2022-04-toolkit-safe-ficient-therapeutic-cells.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.