Gráficamente abstracto. Crédito: Neurona (2022). DOI: 10.1016/j.neuron.2022.11.016
Los trastornos neurodegenerativos como el Alzheimer y el Parkinson resultan de la pérdida de tipos específicos de neuronas debido a la acumulación anormal de proteínas mutantes. Aunque se ha encontrado que regiones específicas del cerebro son particularmente vulnerables en cada uno de estos trastornos, las causas y los mecanismos exactos que subyacen a esta vulnerabilidad diferencial de las células y regiones del cerebro a las proteínas mutantes tóxicas no se conocen bien.
Un estudio reciente del laboratorio de la Dra. Huda Zoghbi, profesora distinguida en el Baylor College of Medicine y directora fundadora del Instituto de Investigación Neurológica Jan and Dan Duncan (Duncan NRI) en el Texas Children’s Hospital, abordó esta pregunta en el contexto de la ataxia espinocerebelosa tipo 1 (SCA 1) y descubrió la diversidad de vías y actores moleculares que contribuyen a este trastorno neurodegenerativo.
El descubrimiento, publicado en Neuronatraza un camino investigativo para una mejor comprensión de la vulnerabilidad regional en otros trastornos neurodegenerativos.
SCA1 es un trastorno neurodegenerativo progresivo que afecta a una o dos de cada 100 000 personas en todo el mundo y se caracteriza principalmente por la pérdida de la coordinación motora y el equilibrio. Es causado por la presencia de una proteína ATXN1 mutante que tiene largos tramos ininterrumpidos llamados repeticiones de poliglutamina (polyQ).
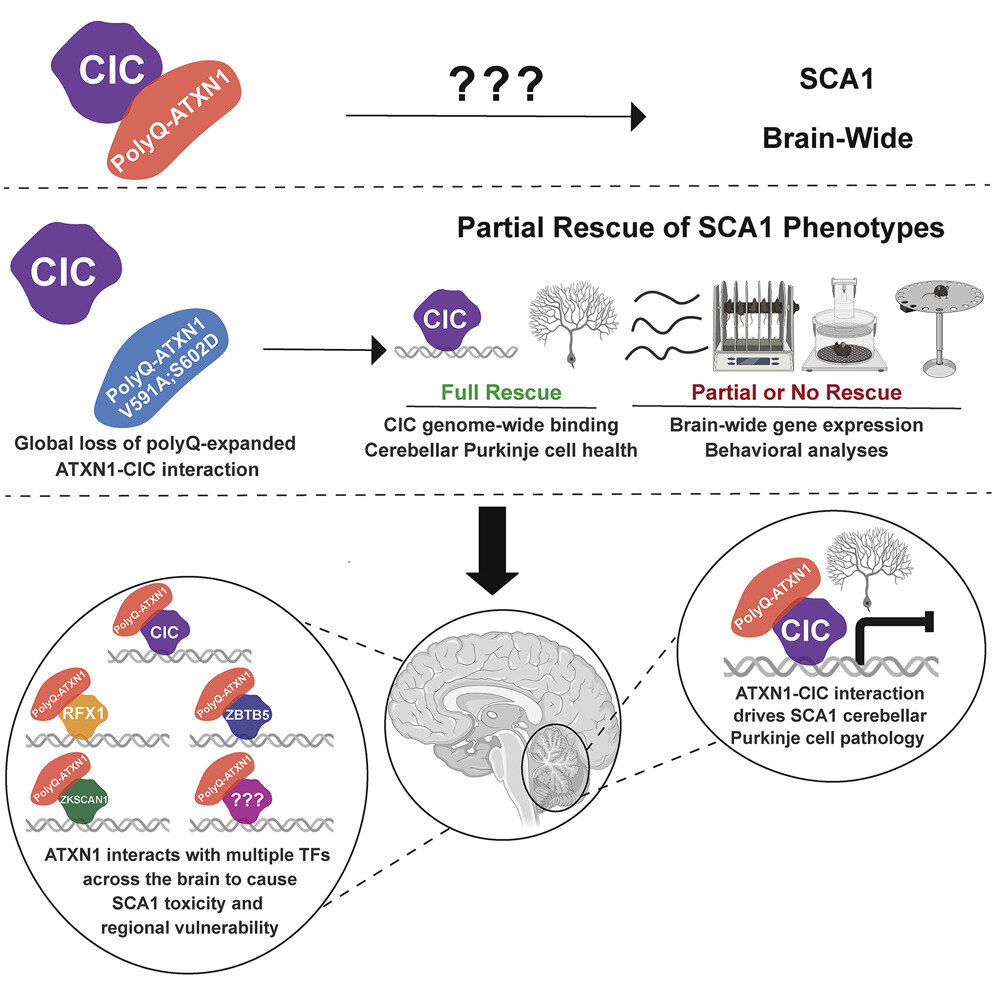
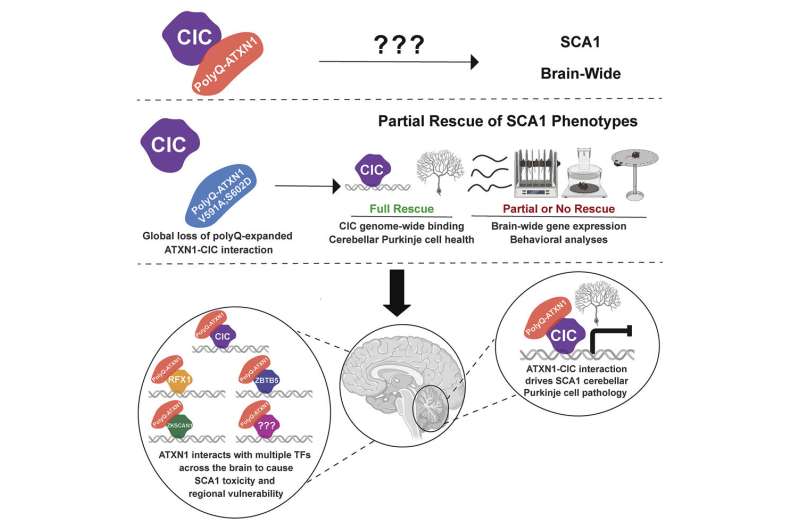
En neuronas sanas, ATXN1 interactúa con capicua (CIC), una proteína que reprime la expresión de varios genes. Por otro lado, cuando el mutante ATXN1 se une a CIC, los genes diana de CIC se hiperexpresan, lo que eventualmente es tóxico para las neuronas. Investigaciones anteriores han demostrado que todos los cambios en las células de Purkinje del cerebelo en modelos de ratón SCA1 son el resultado de la actividad mejorada del complejo ATXN1-CIC.
Sin embargo, la proteína ATXN1 se expresa ampliamente y funciona en varias regiones del cerebro.
«Una pregunta clave que sorprendentemente ha permanecido sin explorar es si CIC impulsa la toxicidad de ATXN1 en otras regiones del cerebro o si otros jugadores moleculares impulsan la toxicidad en otras neuronas afectadas», dijo Zoghbi, quien también es investigador del Instituto Médico Howard Hughes.
Para abordar esta pregunta, Stephanie Coffin, estudiante de posgrado en el laboratorio de Zoghbi, generó un nuevo modelo de ratón SCA1 para imitar la mutación ATXN1 humana y su efecto en todo el cerebro. En este modelo, el gen ATXN1 tiene un tramo de poliglutamina expandido, pero también mutó los dos aminoácidos que son críticos para la interacción ATXN1-CIC.
El equipo de Zoghbi descubrió que estas dos mutaciones eliminaron por completo la interacción ATXN1-CIC en todas las regiones del cerebro.
«La interrupción del complejo ATXN1-CIC condujo a mejoras parciales en los síntomas neurológicos de SCA1, como la falta de coordinación motora, la respiración y una vida útil corta, y solo volvió a la normalidad un subconjunto de los cambios en la expresión génica», dijo Coffin.
«Juntos, estos hallazgos nos dieron una pista de que CIC probablemente no es el único interactor ATXN1 que impulsa SCA1 y que otros actores moleculares pueden estar contribuyendo al desarrollo y progresión de la variedad de síntomas neurológicos observados en pacientes con SCA1 y modelos animales».
Para identificar interactuadores adicionales de ATXN1, realizaron una pantalla de proteómica imparcial utilizando inmunoprecipitación y espectrometría de masas.
«Dado que los cambios transcripcionales son un sello distintivo de SCA1, nos enfocamos en tres factores transcripcionales que se expresan en varias regiones del cerebro humano y del ratón, llamados ZKSCAN1, ZBTB5 y RFX1», agregó Coffin, quien actualmente es gerente del programa de neurociencia en Pelagos. Farmacia.
«Validamos la interacción entre ATXN1 y estos socios recientemente identificados y descubrimos que la expresión de los genes regulados por RFX1 y ZKSCAN1 estaba alterada en ratones SCA1 y neuronas humanas. Además, estos dos socios recientemente identificados, RFX1 y ZKSCAN1, junto con CIC son se predice que regula aproximadamente el 33 % de los genes cuya expresión está alterada en modelos de ratón SCA1, lo que destaca el importante papel que desempeñan en la patogenia de este trastorno».
«Nos sorprendió mucho descubrir que para este trastorno de un solo gen, la proteína mutante usa distintos socios para impulsar la toxicidad en diferentes células cerebrales», dijo Zoghbi. «De hecho, este estudio subraya la importancia de investigar a los socios de otras proteínas impulsoras de enfermedades no solo para otras enfermedades poliglutamínicas sino, en términos generales, para todos los trastornos neurodegenerativos. Es solo a través de estudios tan sistemáticos que podemos comprender los mecanismos que impulsan estas enfermedades y estar en una mejor posición para explorar intervenciones terapéuticas».
Stephanie L. Coffin et al, La interrupción del complejo ATXN1-CIC revela el papel de los interactores ATXN1 nucleares adicionales en la ataxia espinocerebelosa tipo 1, Neurona (2022). DOI: 10.1016/j.neuron.2022.11.016
Citación: Las nuevas proteínas involucradas en la ataxia espinocerebelosa brindan información sobre la vulnerabilidad neuronal selectiva (27 de diciembre de 2022) recuperado el 28 de diciembre de 2022 de https://medicalxpress.com/news/2022-12-proteins-involved-spinocerebellar-ataxia-insight.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.