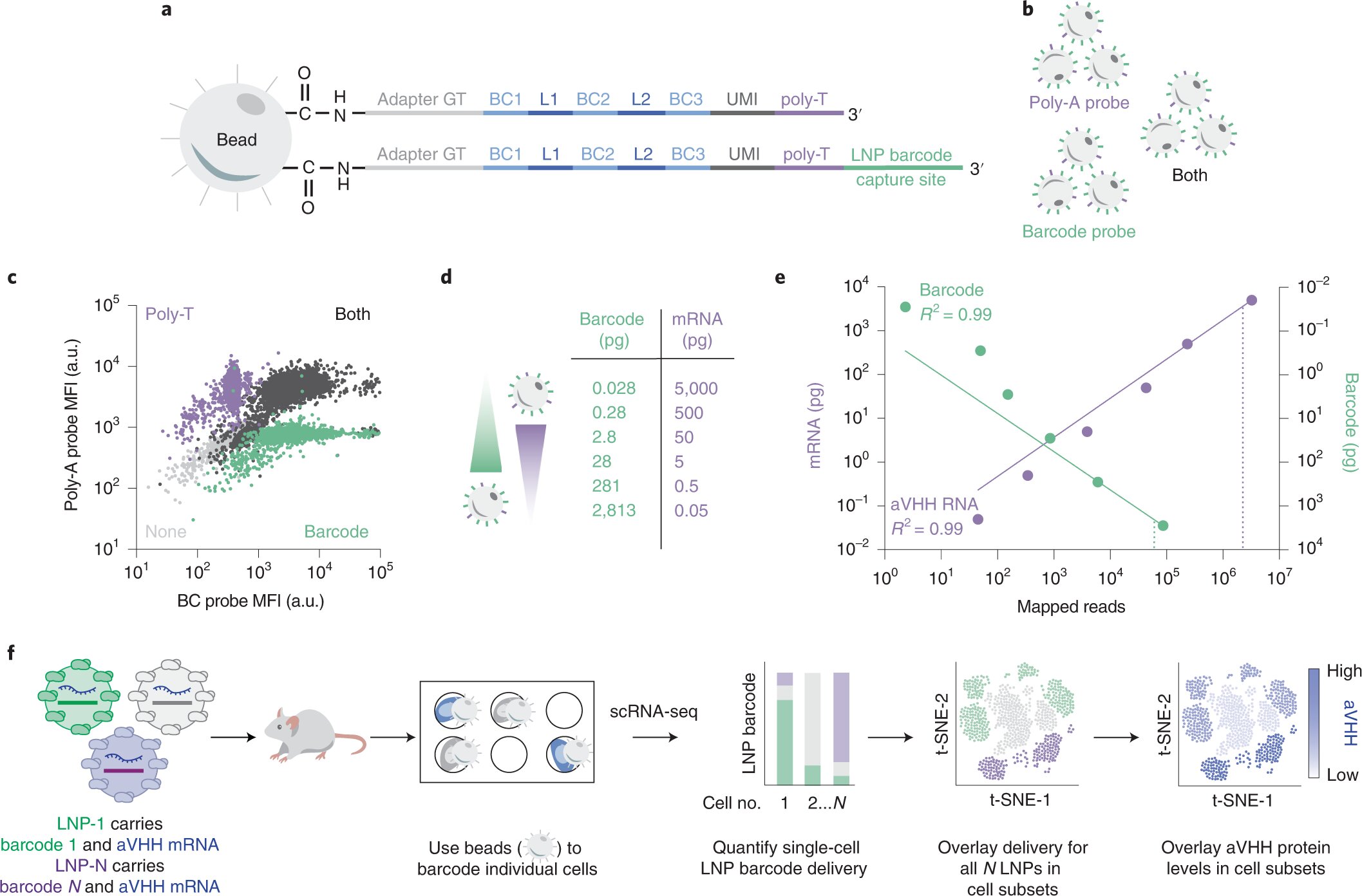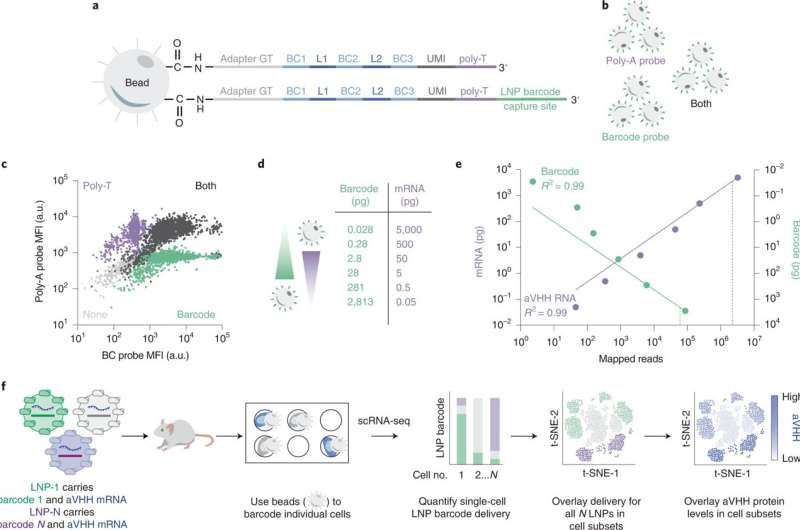
SENT-seq utiliza secuencias de captura ortogonales para generar lecturas multiómicas ajustables. Crédito: Naturaleza Nanotecnología (2022). DOI: 10.1038/s41565-022-01146-9
Las terapias basadas en el ARN mensajero, o ARNm, pueden tratar potencialmente una amplia gama de enfermedades, incluido el cáncer, las enfermedades genéticas y, como el mundo ha aprendido en los últimos años, los virus mortales.
Para que funcionen, estos medicamentos deben administrarse directamente a las células objetivo en burbujas de grasa a nanoescala llamadas nanopartículas lipídicas o LNP: el ARNm no es muy bueno si no llega al tipo de célula correcto.
Un equipo de investigadores del Instituto de Tecnología de Georgia y la Facultad de Medicina de la Universidad de Emory ha dado otro paso hacia la mejora del desarrollo de estos vehículos de reparto hechos a medida, informando sobre su trabajo el 30 de junio en Naturaleza Nanotecnología. Curtis Dobrowolski y Kalina Paunovska, aprendices en el laboratorio de James Dahlman, han desarrollado un sistema para hacer que los estudios preclínicos de nanopartículas sean más predictivos. Sus descubrimientos ya están influyendo en la dirección de la investigación en este campo cada vez más competitivo.
«Estoy muy entusiasmado con este estudio y anticipo cambiar la mayoría de nuestros proyectos futuros a esta metodología», dijo Dahlman, profesor asociado y profesor de carrera temprana de la Fundación McCamish en el Departamento de Ingeniería Biomédica Wallace H. Coulter en Georgia Tech y Emory.
Secuencia de eventos
Durante los últimos años, Dahlman se ha asociado con el profesor Philip Santangelo de Coulter BME en una empresa de investigación muy activa. El laboratorio de Santangelo desarrolla terapias de ARNm y el laboratorio de Dahlman las administra mediante LNP.
Para acelerar el proceso de prueba de la eficacia de sus LNP, el equipo de Dahlman ha desarrollado una técnica llamada código de barras de ADN. En este proceso, los investigadores insertan un fragmento de ADN que corresponde a un LNP dado. A continuación, se inyectan los LNP y, posteriormente, se examinan las células para detectar la presencia de los «códigos de barras» mediante secuenciación genética. El sistema identifica qué códigos de barras han alcanzado qué objetivos específicos, destacando las nanopartículas más prometedoras. Dado que se pueden leer muchas secuencias de ADN a la vez, el proceso de codificación de barras permite realizar muchos experimentos simultáneamente, lo que acelera el descubrimiento de transportadores de nanopartículas lipídicas eficaces.
El código de barras de ADN ha mejorado significativamente el proceso de detección preclínica de nanopartículas. Pero todavía hay una barrera significativa que afecta la entrega de medicamentos. Debido a su diversidad, las células son como blancos en movimiento. Dahlman señaló que las células que antes se pensaba que eran homogéneas se componen de subconjuntos celulares distintos y variados. Su equipo conjeturó que esta heterogeneidad química y genética tiene una poderosa influencia en qué tan bien los LNP pueden administrar terapias de ARNm en las células.
«Las células no tienen una sola proteína que las defina, son complicadas», dijo Dahlman. «Se pueden definir por una combinación de cosas, y si somos honestos, se definen mejor usando todos los genes que expresan o no».
Para probar su hipótesis, los investigadores desarrollaron una nueva herramienta para medir todas estas cosas a la vez. Su sistema de administración de nanopartículas multiómicas se denomina secuenciación dirigida a nanopartículas unicelulares o SENT-seq.
Enfoque multiómico
Usando SENT-seq, los investigadores pudieron cuantificar cómo los LNP entregan códigos de barras de ADN y ARNm en las células, la posterior producción de proteínas facilitada por el fármaco de ARNm, así como la identidad de la célula, en miles de células individuales.
Este enfoque multiómico podría representar un importante avance para el descubrimiento de LNP de alto rendimiento. La técnica SENT-seq permitió al equipo identificar subtipos de células que muestran una captación de nanopartículas particularmente alta o baja, y los genes asociados con esos subtipos.
Entonces, además de probar la eficacia de un medicamento y cómo ciertos subtipos de células reaccionan a las nanopartículas, están identificando qué genes están involucrados en la absorción exitosa de LNP. Y lo están haciendo todo a la vez.
«Los datos sugieren que estos diferentes subconjuntos de células tienen respuestas distintas a las nanopartículas que influyen en qué tan bien funciona una terapia de ARNm», dijo Dahlman. «Todavía queda mucho trabajo por hacer, pero creemos que la capacidad de leer simultáneamente la entrega de nanopartículas de alto rendimiento y la respuesta celular a las nanopartículas conducirá a mejores terapias de ARNm».
La coautora principal, Paunovska, dijo que a ella y a Dobrowolski se les ocurrió la idea del sistema SENT-seq, «orgánicamente, después de dos meses de trabajar juntos».
Dahlman agregó: «Estoy orgulloso del trabajo que Curtis, Kalina y el equipo hicieron en el laboratorio. Creo que este es el comienzo de una fase extremadamente interesante en nuestro trabajo».
Nuevo sistema acelera el cribado de nanopartículas que liberan fármacos
Curtis Dobrowolski et al, Las lecturas multiómicas de células individuales de nanopartículas revelan que la heterogeneidad celular influye en la entrega de ARN mensajero mediada por nanopartículas lipídicas, Naturaleza Nanotecnología (2022). DOI: 10.1038/s41565-022-01146-9
Citación: Nueva técnica de detección podría acelerar y mejorar las terapias de ARNm (4 de julio de 2022) consultado el 4 de julio de 2022 en https://phys.org/news/2022-07-screening-technique-mrna-therapies.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.