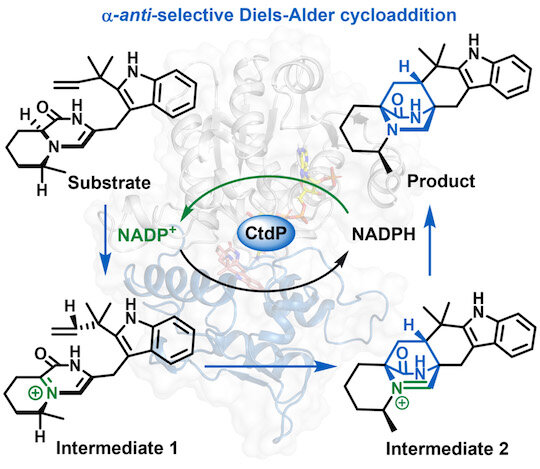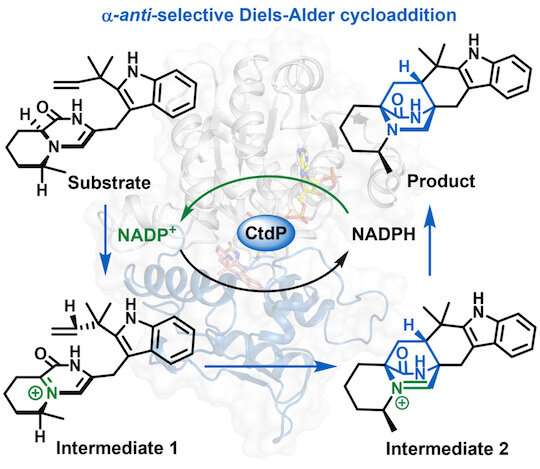
Una nueva Diels-Alderase, CtdP, utiliza un mecanismo único para cebar la sustancia del sustrato mientras convierte la nicotinamida adenina dinucleótido fosfato, o NADP+, en su forma reducida, o NADPH, lo que permite la reacción de Diels-Alder, un método ampliamente utilizado para sintetizar materiales importantes. y productos farmacéuticos. Crédito: Laboratorio Gao/Universidad Rice
Así como la notación de un coreógrafo le dice a un bailarín que adopte una pose particular, una enzima recién descubierta por científicos de la Universidad de Rice es capaz de decirle a moléculas específicas con precisión cómo organizarse, hasta el ángulo de los enlaces de hidrógeno simples.
Los ingenieros biomoleculares de Rice identificaron una nueva Diels-Alderase (DAase), una enzima que cataliza la reacción de Diels-Alder, un método ampliamente utilizado para sintetizar materiales y productos farmacéuticos importantes, desde materias primas para plásticos y combustibles hasta esteroides sintéticos.
Anteriormente se pensaba que la enzima, conocida como CtdP, era un tipo diferente de proteína, un «regulador» que controla la expresión génica. Los reguladores generalmente no cumplen una función catalítica, lo que significa que no pueden «transformar el compuesto A en el compuesto B», dijo el coautor del estudio, Xue Sherry Gao.
La precisión de la actividad catalítica de CtdP es notable. El equipo de Gao pudo identificar una mínima diferencia en la estructura espacial de una molécula, o estereoquímica, como causada directamente por la enzima recién identificada. «Solo cuando se agrega nuestra DAase se obtiene esa estereoquímica muy específica», dijo Gao. «Esto es muy importante, porque un cambio sutil en la estereoquímica de una molécula pequeña puede marcar la diferencia entre una droga y un veneno».
El estudio se publica en Química de la naturaleza.
Descrita por primera vez por Kurt Alder y Otto Diels en 1928, la reacción de Diels-Alder generó una amplia gama de aplicaciones industriales y farmacéuticas, lo que les valió a los dos químicos alemanes el Premio Nobel de química en 1950.
Gao explicó que la reacción de Diels-Alder es «muy útil porque puede facilitar la formación de una amplia gama de estructuras de anillos cíclicos», rasgos característicos de muchos compuestos naturales que son médicamente útiles. Estos productos naturales bioactivos se encuentran en microbios, plantas y otros organismos y pueden usarse como medicamentos o como planos moleculares para diseñarlos.
Sin embargo, la mayoría de las reacciones de Diels-Alder pueden ser difíciles de controlar con la precisión necesaria para lograr la estructura molecular 3D deseada. Aquí es donde entra en juego el descubrimiento CtdP del laboratorio de Gao.
Sabiendo que la estereoquímica de una molécula puede marcar la diferencia entre su comportamiento como fármaco que salva vidas o como veneno letal, Gao sintió curiosidad por saber cómo un organismo fúngico sintetizó la molécula 21R-citrinadina A en solo una de las cuatro configuraciones posibles, o «productos estereoquímicos». .»
«Nuestra pregunta es, ¿cómo controla el organismo vivo la estereoquímica de este compuesto con tanta precisión mientras que lograr el mismo resultado a través de la síntesis orgánica es tan desafiante?» ella dijo.
CtdP resultó ser una de las respuestas. «Nuestra enzima asegura que la reacción química se lleve a cabo con el control estereoquímico deseado», dijo.
Las enzimas aceleran o hacen que una reacción química sea más eficiente, pero por lo general no determinan si ocurrirá o no una reacción. Lo que diferencia a CtdP de otras DAasas es que utiliza un mecanismo único para cebar la sustancia del sustrato y, al mismo tiempo, convierte la nicotinamida adenina dinucleótido fosfato, o NADP+, en su forma reducida, o NADPH, lo que hace posible la reacción de Diels-Alder en primer lugar. , dijo Gao. «En resumen, nuestro estudio revela una nueva clase de DAases», dijo.
«Muy pocas DAasas funcionan como nuestra enzima y sintetizan muy estrictamente una reacción química que es imposible sin ella», dijo. «Esperamos que nuestro descubrimiento ayude a desarrollar biocatalizadores que permitan la producción de productos farmacéuticos útiles en un futuro próximo».
Gao y sus colaboradores utilizaron análisis informáticos, pruebas in vivo e in vitro y cristalografía de rayos X para determinar la estructura molecular y los mecanismos subyacentes a la actividad catalítica de CtdP.
Más información:
Zhiwen Liu et al, Una cicloadición de Diels-Alder mediada por redox catalizada por enzimas similar a NmrA con antiselectividad, Química de la naturaleza (2023). DOI: 10.1038/s41557-022-01117-6
Citación: Nueva enzima podría significar mejores fármacos (23 de enero de 2023) recuperado el 23 de enero de 2023 de https://phys.org/news/2023-01-enzyme-drugs.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.