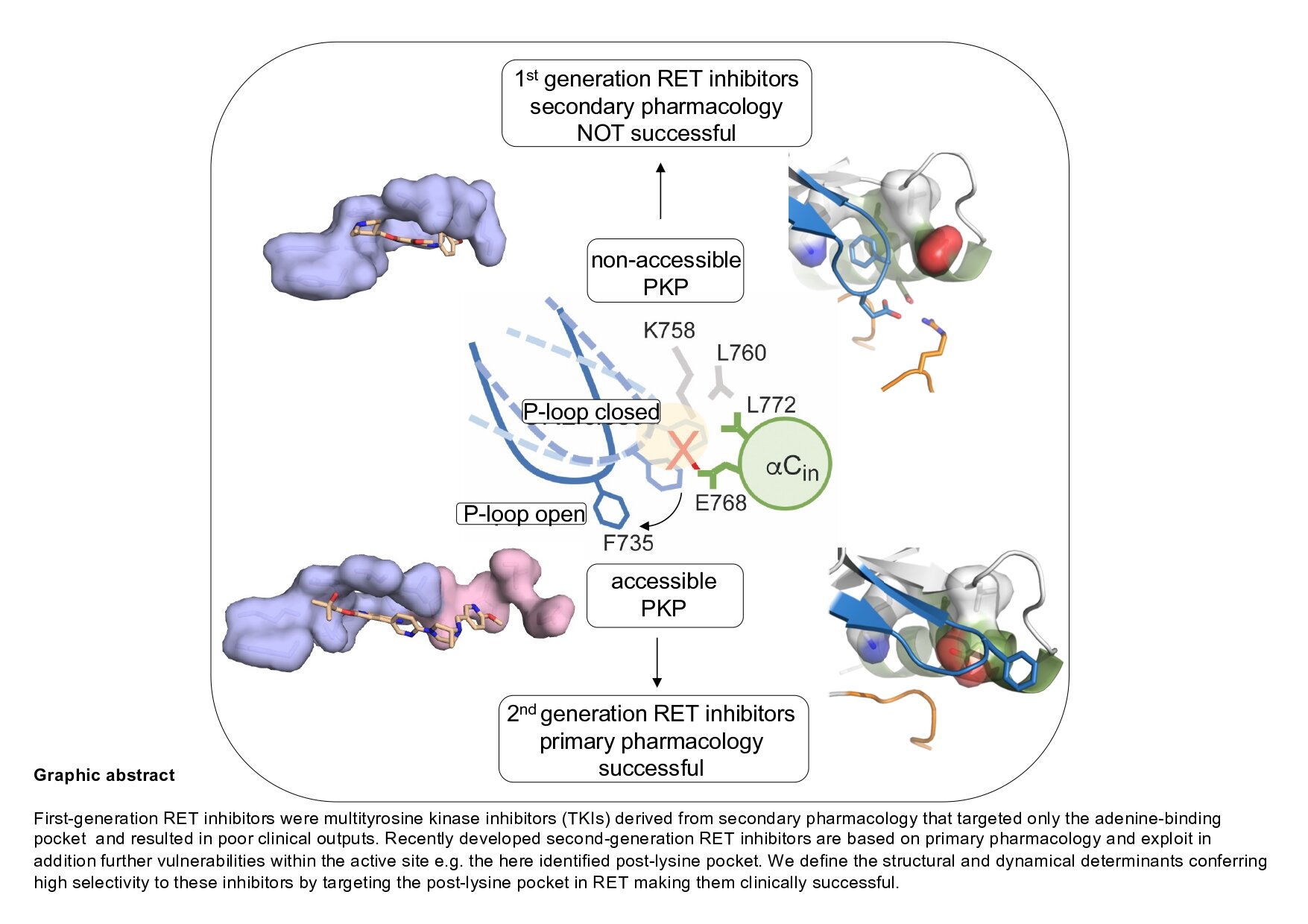
Resumen gráfico. Crédito: cnio
RET es una proteína receptora con actividad tirosina quinasa que puede transferir un grupo fosfato del ATP a otras moléculas modificando su forma y función en vías de señalización que son esenciales para la organogénesis y el mantenimiento de los tejidos. Las alteraciones genéticas de ganancia de función en RET, como mutaciones puntuales o reordenamientos cromosómicos que producen fusiones oncogénicas, están implicadas en algunos tipos de cáncer, especialmente en el de tiroides y, con menos frecuencia, en el de pulmón y mama, entre otros. Las terapias anticancerígenas actuales contra tumores dirigidos por RET se basan en inhibidores competitivos de ATP de la actividad catalítica de RET. Los inhibidores de segunda generación, que incluyen LOXO-292 (selpercatinib) y BLU-667 (pralsetinib), han sido aprobados por la FDA y dan como resultado respuestas clínicas notables en pacientes con cáncer.
El Grupo de Quinasas, Fosforilación de Proteínas y Cáncer del Centro Nacional de Investigaciones Oncológicas (CNIO), liderado por Iván Plaza Menacho, ha identificado con éxito características estructurales y dinámicas aprovechadas por estos inhibidores, y en particular una bolsa críptica dentro del sitio activo que confería alta especificidad de estos compuestos. “Ya se resolvió la estructura cristalina del dominio catalítico RET en complejo con estos inhibidores, pero no se identificaron los bolsillos crípticos en el sitio activo, ya que no siempre son accesibles debido a los cambios dinámicos y conformacionales que la estructura cristalina no capta. , remarca Plaza-Menacho.
El Grupo de Quinasas, Fosforilación de Proteínas y Cáncer se centra en la caracterización estructural y funcional detallada de una familia de proteínas denominadas quinasas que están implicadas en el cáncer. Esta información puede traducirse en el diseño de mejores compuestos e inhibidores que darán como resultado terapias mejoradas. «Los inhibidores de RET de segunda generación, que han sido aprobados recientemente por la FDA para tratar los cánceres de tiroides y de pulmón provocados por RET, se unen al sitio activo de una manera inusual en comparación con los inhibidores de RET prototípicos. Sin embargo, no entendimos completamente por qué eran tan eficaz», añade Plaza-Menacho.
Actualmente, el grupo liderado por Plaza-Menacho trabaja en estrecha colaboración con el Programa de Terapéutica Experimental del CNIO en la identificación, diseño y desarrollo de nuevos compuestos dirigidos al bolsillo críptico identificado y otros sitios alostéricos. Esperamos que algunos de estos éxitos conduzcan a medicamentos que puedan usarse potencialmente en terapias de precisión y personalizadas para tratar cánceres impulsados por RET en el futuro, dijo Plaza-Menacho. Ya se han descrito mutaciones refractarias que confieren resistencia a estos inhibidores. Los autores del estudio también brindan algunas pautas para el diseño de nuevos medicamentos que puedan superar los efectos de tales mutaciones refractarias.
La investigación fue publicada en el Revista de investigación avanzada.
Moustafa A. Shehata et al, Los determinantes estructurales y dinámicos para la inhibición altamente selectiva de la quinasa RET revelan una drogueabilidad críptica, Revista de investigación avanzada (2022). DOI: 10.1016/j.jare.2022.05.004
Citación: Los investigadores identifican vulnerabilidades crípticas en una oncoproteína que podría usarse en nuevos medicamentos contra el cáncer (24 de junio de 2022) consultado el 25 de junio de 2022 en https://medicalxpress.com/news/2022-06-cryptic-vulnerabilities-oncoprotein-anti -cancer-drogas.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.