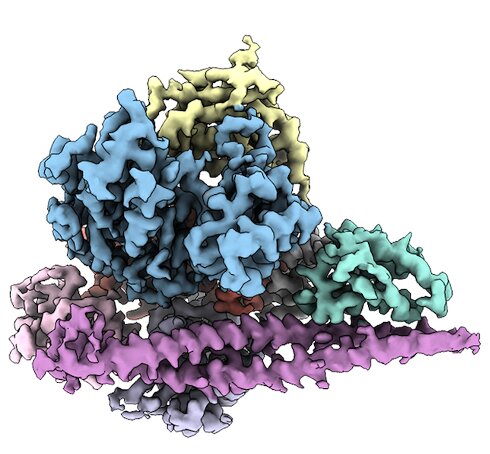
Al determinar la estructura tridimensional de PI3Kα (que se muestra), los investigadores de Scripps allanaron el camino hacia medicamentos que atacan la proteína en las células cancerosas. Crédito: Scripps Research
Para diseñar medicamentos que detengan el crecimiento de cánceres agresivos, es útil conocer las estructuras de las proteínas que aceleran los motores de los cánceres.
En una serie de tres artículos publicados en procedimientos de la Academia Nacional de CienciasLos científicos de Scripps Research han iluminado la estructura tridimensional de la fosfoinositida 3-quinasa alfa (PI3Kα), una proteína que a menudo muta en las células cancerosas. Además, el equipo de investigación arrojó luz sobre cómo cambia esa estructura con las mutaciones asociadas con el cáncer, allanando el camino para medicamentos que podrían atacar solo las versiones mutadas.
«Esperamos que estos hallazgos estructurales detallados conduzcan al descubrimiento de fármacos que afecten a las células cancerosas pero no a las células sanas», dice el autor principal Peter Vogt, Ph.D., profesor del Departamento de Medicina Molecular de Scripps Research. «Eso podría eliminar potencialmente los efectos secundarios asociados con los medicamentos PI3Kα actuales».
PI3Kα juega un papel central en la supervivencia y el crecimiento celular. En las células sanas, la proteína se activa y desactiva según sea necesario. Pero en numerosos tipos de cáncer, incluidos los de mama, colorrectal, endometrial y cerebral, las mutaciones en PI3Kα lo hacen activo todo el tiempo, fomentando el crecimiento descontrolado de los tumores.
Los fármacos actuales que pretenden frenar la PI3Kα se unen a una sección de la proteína que rara vez cambia entre versiones sanas y mutadas; esto significa que todo el PI3Kα del cuerpo está apagado. Por eso, estos inhibidores de PI3Kα conllevan una larga lista de efectos secundarios y toxicidades.
«Para resolver este problema, debe crear inhibidores que solo reconozcan las versiones mutadas de PI3Kα», dice Vogt. «Pero para hacer eso, se necesita información estructural sobre lo que diferencia a la PI3Kα mutada e hiperactiva de la PI3Kα normal».
Esta no es una tarea fácil: PI3Kα es una proteína particularmente flexible y «ondulada», por lo que es difícil obtener una instantánea única de su estructura. El grupo de Vogt, sin embargo, descubrió que cuando la PI3Kα se unía a uno de los inhibidores existentes, se volvía más estable.
En PNAS trabajos publicados en noviembre 2021 y septiembre 2022, utilizaron un tipo de técnica de imagen conocida como microscopía electrónica criogénica (crio-EM) para determinar la estructura tridimensional de PI3Kα. Con este conocimiento, primero examinaron la estructura de PI3Kα unida al inhibidor. Luego, para visualizar la proteína sin el inhibidor, utilizaron moléculas reticuladas para unir diferentes partes de PI3Kα a sí mismas, estabilizando las partes más flexibles de la proteína.
Más recientemente, el equipo de investigación utilizó la misma caja de herramientas crio-EM para reconstruir la estructura de dos versiones mutadas de PI3Kα que se encuentran a menudo en las células cancerosas. Ese trabajo, publicado el mes pasado en PNASmostró cómo algunos segmentos de la PI3Kα mutada se asemejan a la forma activada de PI3Kα.
«Hay cambios estructurales bastante drásticos», dice Vogt. «Y al final, los cambios esencialmente imitan la forma activada normal de la proteína, con la única diferencia de que siempre está en esta estructura activa».
Los hallazgos apuntan hacia formas de usar medicamentos para apagar esta versión siempre activa de PI3Kα en las células cancerosas, sin apagar la PI3Kα saludable. La clave, dice Vogt, es que los medicamentos deberán unirse a una parte diferente de la proteína PI3Kα a la que se unen los inhibidores de PI3Kα existentes, una parte que varía estructuralmente entre las versiones sanas y mutadas de la proteína.
Su grupo de laboratorio está dando seguimiento a esta investigación con estudios adicionales que revelan cómo los medicamentos actuales cambian la estructura de PI3Kα.
Más información:
Xiao Liu et al, estructuras Cryo-EM de mutaciones en el dominio helicoidal y quinasa específicas del cáncer de PI3Kα, procedimientos de la Academia Nacional de Ciencias (2022). DOI: 10.1073/pnas.2215621119
Citación: Los estudios estructurales ofrecen una guía práctica para diseñar medicamentos contra el cáncer (9 de diciembre de 2022) consultado el 9 de diciembre de 2022 en https://phys.org/news/2022-12-how-to-cancer-drugs.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.