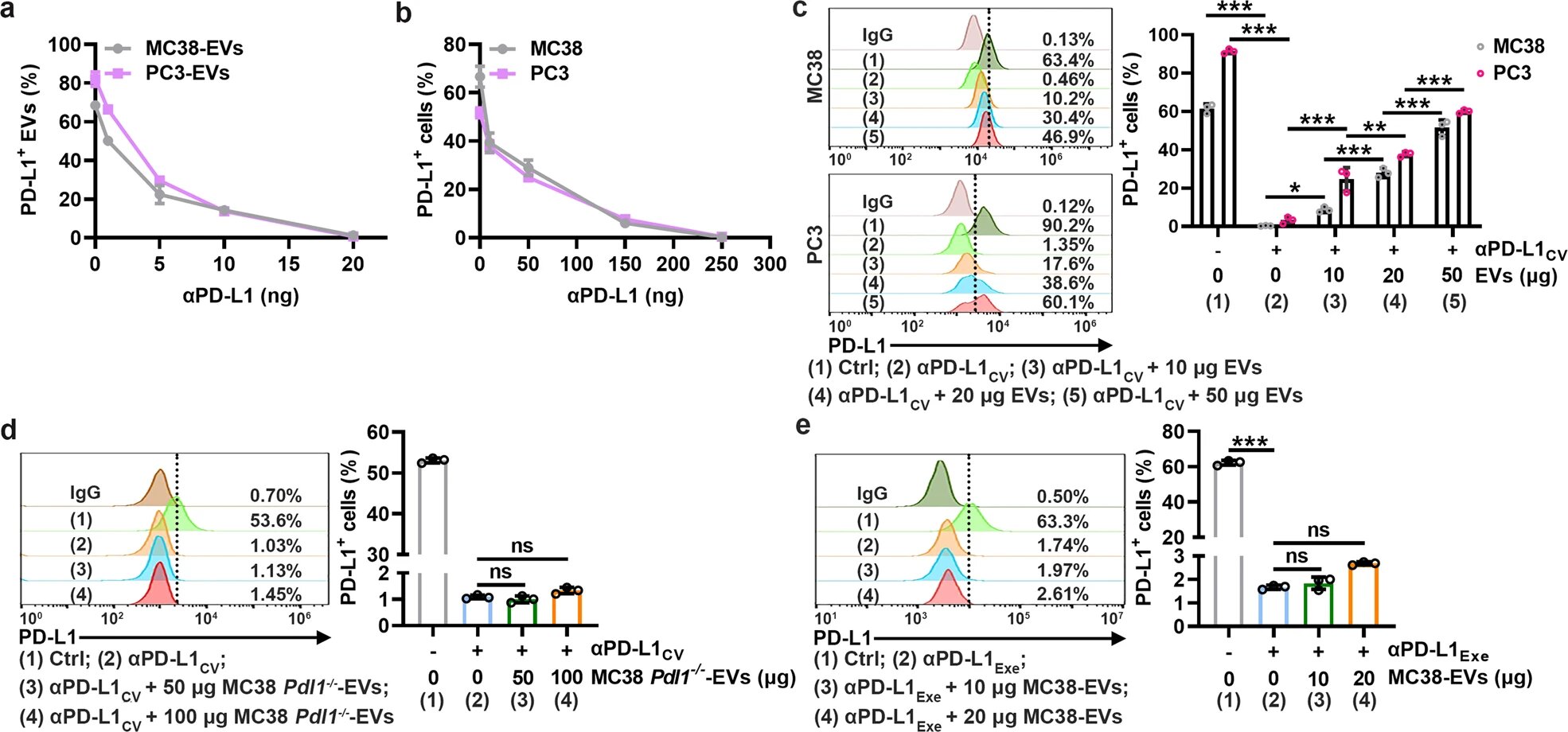
TEV PD-L1 compite con PD-L1 en las células tumorales para unirse a αPD-L1. a, b MC38-EV y PC3-EV (1 μg) (a) o celdas MC38 y PC3 (1 × 105) (b) se coincubaron con las dosis indicadas de αPD-L1 en 100 μl de medio durante 30 min. Luego, PD-L1 en vehículos eléctricos (a) o celdas (b) fue detectado por citometría de flujo. C Un total de 1 × 105 Las células MC38 y PC3 se coincubaron con αPD-L1CV con o sin los EV correspondientes a las dosis indicadas en 100 μl de medio durante 30 min. Luego, se detectó PD-L1 en las células mediante citometría de flujo. d, mi Un total de 1 × 105 Las células MC38 se coincubaron con αPD-L1CV (d) o αPD-L1Exe (mi) en presencia de las dosis indicadas de MC38 Pdl1−/−-VE (d) o MC38-EV (mi) en 100 μl de medio durante 30 min. Luego, se detectó PD-L1 en células MC38 mediante citometría de flujo. El αPD-L1 para coincubación y detección reconoce el mismo epítopo en PD-L1. Se muestran los resultados representativos de tres experimentos independientes (norte= 3). *PAGS PP Inmunología celular y molecular (2022). DOI: 10.1038/s41423-022-00926-6
Los inhibidores del punto de control inmunitario, incluidos los anticuerpos anti-PD-1 y anti-PD-L1 (αPD-1 y αPD-L1), han revolucionado la inmunoterapia tumoral. Aunque αPD-1 y αPD-L1 muestran una excelente eficacia en varios tipos de tumores, incluso en pacientes con tumores avanzados, solo el 10-30 % de los pacientes responden a la terapia con αPD-1 y αPD-L1 debido a la resistencia primaria.
Las vesículas extracelulares (VE) están muy involucradas en la progresión del tumor. PD-L1+ Los EV derivados de tumores (TEV) causan inmunosupresión sistémica y posiblemente resisten el bloqueo de αPD-L1. Sin embargo, si y cómo PD-L1+ Los TEV median la resistencia a la terapia con αPD-L1 aún se desconoce.
Recientemente, el equipo de investigación dirigido por el Prof. Cai Zhijian de la Facultad de Medicina de la Universidad de Zhejiang publicó un artículo titulado «Las vesículas extracelulares tumorales median la resistencia a la terapia anti-PD-L1 mediante el señuelo de anti-PD-L1» en Inmunología celular y molecular. Los hallazgos revelan un nuevo mecanismo de resistencia a la terapia específico de αPD-L1 mediado por TEV, lo que proporciona estrategias prometedoras para mejorar la eficacia de αPD-L1.
En este estudio, los investigadores encontraron que los TEV podían unirse a αPD-L1 y competir con las células tumorales a través de PD-L1 in vitro. Posteriormente, los autores visualizaron las interacciones de αPD-L1 y PD-L1 tumoral como una mancha roja fluorescente detectada mediante un ensayo de ligadura de proximidad (PLA). Las manchas de PLA en los tejidos tumorales obviamente se redujeron mediante la inyección de MC38-EV pero no de MC38 Pdl1.-/--EV, mientras que las manchas de PLA en los tejidos tumorales aumentaron significativamente al inhibir la secreción de EV endógenos al eliminar Rab27a.
Además, se descubrió que después de unirse a los TEV, los fagocitos en el hígado y el bazo captan más αPD-L1, lo que conduce a una degradación acelerada y una disminución de la liberación tumoral de αPD-L1. Además, encontraron que el agotamiento de los macrófagos por Pexidartinib (PLX3397), que redujo notablemente la cantidad de monocitos periféricos y macrófagos hepáticos, eliminó la resistencia a la terapia con αPD-L1 en ratones portadores de TRAMP-C2.
Estos resultados demuestran que dirigirse a los macrófagos previene eficazmente la eliminación de αPD-L1 unido a TEV, mejorando así la eficiencia de utilización y la resistencia a la terapia de αPD-L1.
«En el tejido tumoral, debido al ambiente de alta presión, menos anticuerpos podrían infiltrarse en la profundidad de los tejidos tumorales. Al mismo tiempo, estos anticuerpos podrían ser capturados rápidamente por una gran cantidad de TEV. Por lo tanto, el consumo de αPD- Se debe prestar más atención a la L1 mediada por TEV en la terapia clínica», dijo el Prof. Cai.
Los macrófagos que rodean los ganglios linfáticos bloquean la progresión del melanoma y otros tipos de cáncer
Jiming Chen et al, Las vesículas extracelulares tumorales median la resistencia a la terapia anti-PD-L1 al atraer anti-PD-L1, Inmunología celular y molecular(2022). DOI: 10.1038/s41423-022-00926-6
Proporcionado por la Universidad de Zhejiang
Citación: Los científicos revelan un nuevo mecanismo de resistencia a la terapia específica de αPD-L1 mediado por TEV (31 de octubre de 2022) consultado el 31 de octubre de 2022 en https://medicalxpress.com/news/2022-10-scientists-reveal-tev-mediated-pd- l1-terapia-especifica.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.