Virus (EBV y KSHV) que rodean las células. Crédito: Laboratorio Damania
Los virus del herpesvirus asociado al sarcoma de Kaposi (KSHV) y el virus de Epstein-Barr (EBV) se han relacionado con varios tipos de cáncer. Por primera vez, los científicos de la Facultad de Medicina de la UNC han descubierto que estos virus utilizan una proteína humana llamada factor de barrera a la autointegración 1, o BAF, para evadir nuestra respuesta inmunitaria innata, lo que permite que los virus se propaguen y causen enfermedades.
Estos hallazgos, publicados en Comunicaciones de la naturalezasugieren que BAF y las proteínas relacionadas podrían ser objetivos terapéuticos para evitar que estos virus se propaguen y provoquen cánceres, como el sarcoma de Kaposi, el linfoma no Hodgkin, el linfoma de Hodgkin, la enfermedad multicéntrica de Castleman, el carcinoma nasofaríngeo y el cáncer gástrico.
«Los virus están en una batalla constante con el sistema inmunitario celular, que incluye la proteína cíclica GMP-AMP sintasa, o cGAS, que se une al ADN viral y hace sonar la alarma para desencadenar respuestas inmunitarias y combatir a los invasores virales», dijo la autora principal Blossom. Damania, Ph.D., Profesor Distinguido Boshamer de Microbiología e Inmunología y miembro del Lineberger Comprehensive Cancer Center. «Descubrimos que KSHV y EBV usan una proteína de célula huésped diferente, BAF, para evitar que cGAS haga sonar la alarma».
Los virus han evolucionado con los humanos durante millones de años, por lo que no sorprende que hayan desarrollado trucos para evadir nuestras respuestas inmunitarias naturales o innatas. Descubrir con precisión cómo hacen esto los virus es la base para crear vacunas y terapias para superar sus trucos.
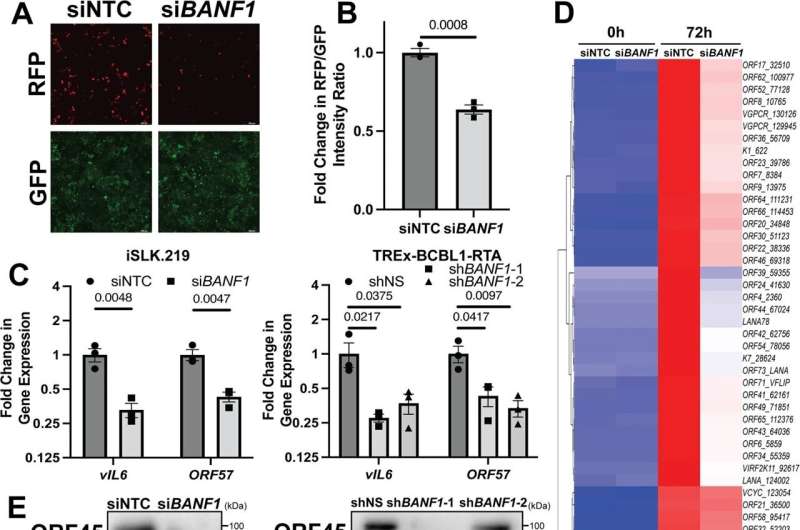
Se requiere BAF para la reactivación óptima de KSHV desde la latencia. Las células iSLK.219 se transfectaron con ARNip de control no dirigido (NTC) o BANF1 apuntando a siRNA 48 h antes de la adición de 25 ng/mL de doxiciclina. Las células TREx-BCBL1-RTA se transdujeron con shRNA lentiviral durante 72 h antes de la adición de 1000 ng/mL de doxiciclina. A Imágenes de microscopía fluorescente de células iSLK.219 para señal RFP y GFP a las 72 h después del tratamiento con doxiciclina. B La fluorescencia se cuantificó mediante un lector de placas. C Las células se recolectaron para el ARN a las 72 h (iSLK.219) o 96 h (TREx-BCBL1-RTA) después del tratamiento con doxiciclina y se realizó una RT-qPCR posterior para cuantificar la expresión de las transcripciones de ARNm viral. D iSLK.219 cDNA se preparó a partir de células recolectadas a las 0 hy 72 h después del tratamiento con doxiciclina. Se realizó un perfil de expresión génica global de KSHV. Los datos que se muestran son la puntuación Z del cambio de pliegue (2-ΔΔCt) sobre la expresión media geométrica de tres genes de limpieza promediados sobre dos réplicas biológicas independientes. El mapa de calor se preparó utilizando Partek Flow. mi Los lisados celulares se prepararon a las 72 h (iSLK.219) o 96 h (TREx-BCBL1-RTA) después del tratamiento con doxiciclina y se analizaron mediante transferencia Western con los anticuerpos indicados. F Las células se recolectaron y el ARN se aisló a las 48 h después de la transfección del siRNA y posteriormente se realizó RT-qPCR para cuantificar BANF1 transcripciones de ARNm. GRAMO Los lisados celulares se prepararon a las 48 h posteriores a la transfección de siRNA o 72 h posteriores a la transducción de shRNA y se analizaron mediante transferencia Western con el anticuerpo indicado. PAG los valores son el resultado de Student de dos colas T pruebas a menos que se especifique lo contrario. Las barras de error indican el error estándar de la media de tres réplicas biológicas independientes. Crédito: Comunicaciones de la naturaleza (2023). DOI: 10.1038/s41467-023-35898-2
En el caso de KSHV y EBV, la expresión de BAF aumenta tras la infección, lo que sugiere que estos virus se aprovechan de esta proteína huésped para mitigar la respuesta inmunitaria a la infección. En una serie de experimentos, el laboratorio de Damania descubrió que BAF contribuye a la degradación del sensor de ADN cGAS. Con menos proteína cGAS disponible en la célula infectada para detectar el ADN, las células generan respuestas inmunitarias más débiles, lo que permite que estos dos virus se repliquen y propaguen de manera más eficiente.
«BAF permite que EBV y KSHV se reactiven desde la latencia, se repliquen y se desarrollen más», dijo el primer autor Grant Broussard, estudiante graduado en el plan de estudios de Genética y Biología Molecular en UNC Lineberger. «Nuestro estudio destaca el papel destacado que desempeñan las vías de detección de ADN como la vía cGAS en el control de la infección viral».
Hizo hincapié en que interrumpir la actividad de BAF con terapias dirigidas podría reducir sus efectos inmunosupresores, restringiendo así la replicación de estos virus para prevenir la propagación de la enfermedad.
Damania, que es becaria de la Sociedad de Lucha contra la Leucemia y el Linfoma e investigadora de enfermedades infecciosas del Burroughs Wellcome Fund, agregó: «La prevención de la replicación lítica evitará la transmisión de estos virus y también reducirá la carga mundial de cáncer asociada con estos dos virus».
Más información:
Grant Broussard et al, Barrier-to-autointegration factor 1 promueve la reactivación de gammaherpesvirus desde la latencia, Comunicaciones de la naturaleza (2023). DOI: 10.1038/s41467-023-35898-2
Citación: Los científicos identifican la proteína que ayuda a los virus que causan cáncer a evadir la respuesta inmunitaria (6 de febrero de 2023) consultado el 6 de febrero de 2023 en https://medicalxpress.com/news/2023-02-scientists-protein-cancer-causing-viruses-evade. html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.