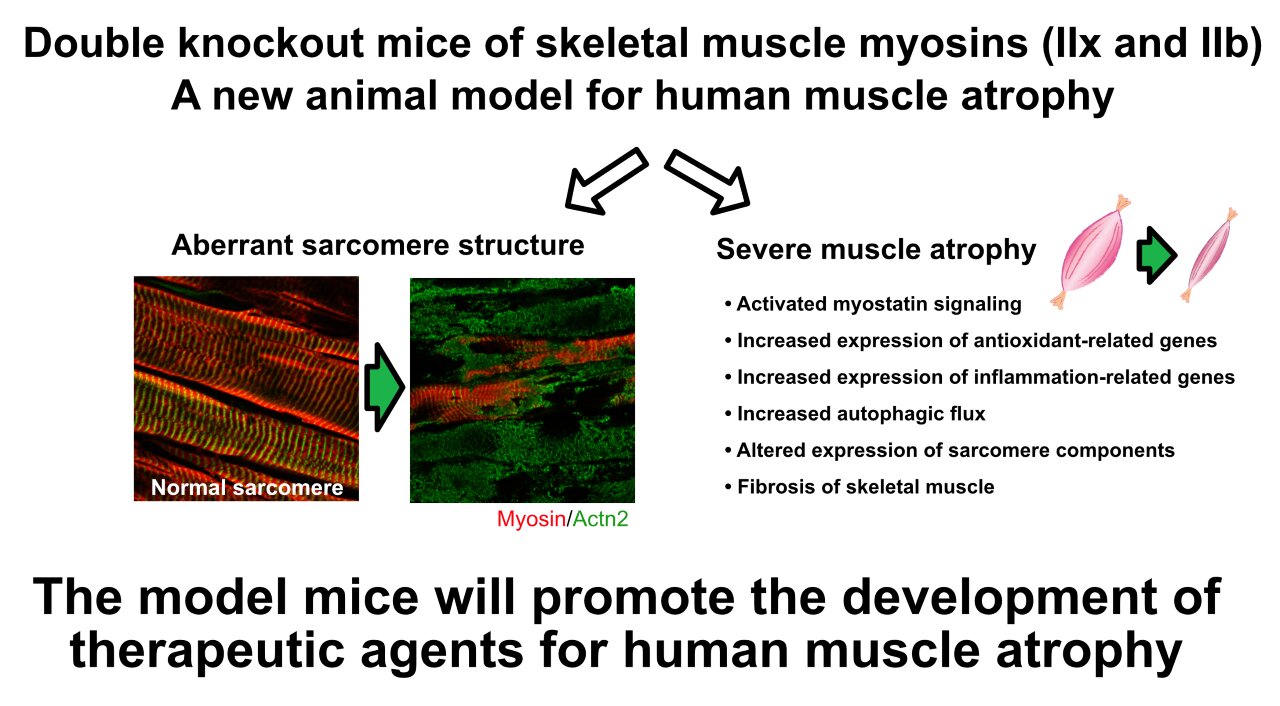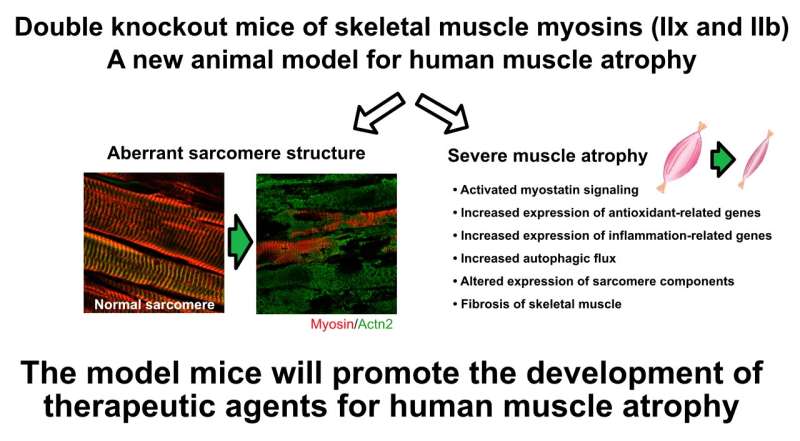
Los ratones con doble inactivación de miosina muestran estructuras de sarcómero anómalas y atrofia muscular grave, lo que sirve como un modelo de enfermedad útil y ayuda potencialmente al desarrollo de terapias contra la atrofia muscular humana. Crédito: Keisuke Hitachi de la Universidad de Salud de Fujita
Los músculos están formados por proteínas. La miosina, una proteína fibrosa, sirve como motor molecular y convierte la energía química almacenada dentro de nuestro cuerpo en energía mecánica. La asociación sinérgica entre las proteínas musculares miosina y actina da lugar a la contracción y relajación del músculo esquelético, lo que permite que el cuerpo se mueva. Por lo tanto, una disminución de la masa muscular (es decir, atrofia del músculo esquelético) da como resultado una función motora reducida.
Los pacientes con atrofia del músculo esquelético sufren de músculos débiles y encogidos. Sin embargo, los fundamentos genéticos de los trastornos de atrofia del músculo esquelético humano no están del todo claros. En un estudio reciente publicado en El Diario FASEBun grupo de investigadores ha descubierto una asociación entre la atrofia del músculo esquelético en un modelo de ratón y la ausencia simultánea de dos tipos de miosina.
La cadena pesada de miosina del músculo esquelético o «MyHC» es un componente fundamental del sarcómero, la unidad contráctil básica de una fibra muscular. Las proteínas correspondientes «MyHC-IIx» y «MyHC-IIb» están codificadas por los genes Myh1 y Myh4, respectivamente. Usando ratones que tenían simultáneamente deficiencia de MyHC-IIx y MyHC-IIb, el equipo de investigación delineó, por primera vez, el papel de MyHC-IIx y MyHC-IIb en la atrofia del músculo esquelético.
«MyHC-IIx y MyHC-IIb abundan en los músculos rápidos y producen abundante potencia instantánea. MyHC-IIb es apenas detectable en los músculos esqueléticos humanos. Producimos ratones genéticamente modificados con la pérdida simultánea de MyHC-IIx y MyHC-IIb mediante la introducción de tonterías mutaciones de cambio de marco en los genes Myh1 y Myh4, imitando la pérdida de MYH1 en el músculo esquelético humano. Los ratones deficientes en estos dos tipos de MyHC mostraron síntomas de atrofia muscular muy severos y murieron dentro de las primeras cuatro semanas de vida «, dice el Dr. Keisuke Hitachi de Fujita Health University, quien planeó el diseño experimental general.
Los investigadores realizaron una serie de observaciones clave durante sus análisis detallados de doble eliminación (dKO; eliminación tanto de MyHC-IIx como de MyHC-IIb). Por ejemplo, registraron una reducción drástica de la masa muscular esquelética en los ratones dKO en la fase de destete de 2 a 3 semanas de edad. Aunque los ratones dKO parecían normales después del nacimiento y hasta las 2 semanas de edad, comenzaron a mostrar una atrofia muscular esquelética severa después de las 2 semanas. Curiosamente, los ratones dKO también mostraron niveles bajos de glucosa y colesterol alto, un signo de nutrición deteriorada.
En ratones dKO de 3 semanas de edad, se elevó la producción de otros MyHC del músculo esquelético, como MyHC-I, MyHC-IIa, MyHC-neo y MyHC-emb. Sin embargo, este aumento no pudo compensar la pérdida de MyHC-IIx y MyHC-IIb. Las deficiencias en la función motora se evidenciaron aún más por las estructuras anormales del sarcómero observadas en los ratones dKO. En general, los hallazgos indican que la pérdida simultánea de estos dos MyHC clave del músculo esquelético es significativamente perjudicial para la función del músculo esquelético posnatal en ratones.
El autor principal, el Dr. Kunihiro Tsuchida, profesor del Instituto de Ciencias Médicas Integrales de la Universidad de Salud de Fujita, dice: «Los experimentos de eliminación doble de MyHC indicaron que la deficiencia de miosina provoca la activación de varias vías de señalización que desencadenan la atrofia del músculo esquelético. En ratones amiotróficos, las microestructuras necesarias para el colapso de la contracción muscular».
Y agrega: «El fenotipo de los ratones dKO fue similar al observado en humanos con atrofia muscular inducida por el cáncer. Por lo tanto, estos ratones dKO podrían servir como un modelo animal útil y brindar información para desarrollar terapias para combatir la atrofia muscular y los problemas relacionados con los músculos». enfermedades en humanos».
Curiosamente, los trastornos del músculo esquelético aún no se han relacionado con los genes Myh1 y Myh4 en humanos. Sin embargo, este estudio establece claramente un vínculo entre la pérdida simultánea de MyHC-IIx y MyHC-IIb y la atrofia del músculo esquelético en un modelo de ratón, y los vínculos ahora podrían explorarse en humanos.
Dado que los músculos esqueléticos constituyen del 30 al 40 % de nuestro peso corporal y son críticos para el movimiento muscular, este estudio tiene enormes implicaciones desde el punto de vista traslacional. Podría ayudar a dilucidar los mecanismos moleculares de los trastornos de desgaste del músculo esquelético causados por la pérdida de MyHC del músculo esquelético en la atrofia muscular humana y ayudar potencialmente en la exploración de estrategias de tratamiento.
Keisuke Hitachi et al, La pérdida simultánea de la cadena pesada IIx y IIb de la miosina del músculo esquelético causa hipoplasia severa del músculo esquelético en ratones posnatales, El Diario FASEB (2022). DOI: 10.1096/fj.202200581R
Proporcionado por la Universidad de Salud de Fujita
Citación: Los científicos demuestran atrofia muscular severa en ratones postnatales que carecen de dos miosinas críticas (14 de diciembre de 2022) recuperado el 14 de diciembre de 2022 de https://medicalxpress.com/news/2022-12-scientists-severe-muscle-atrophy-postnatal.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.