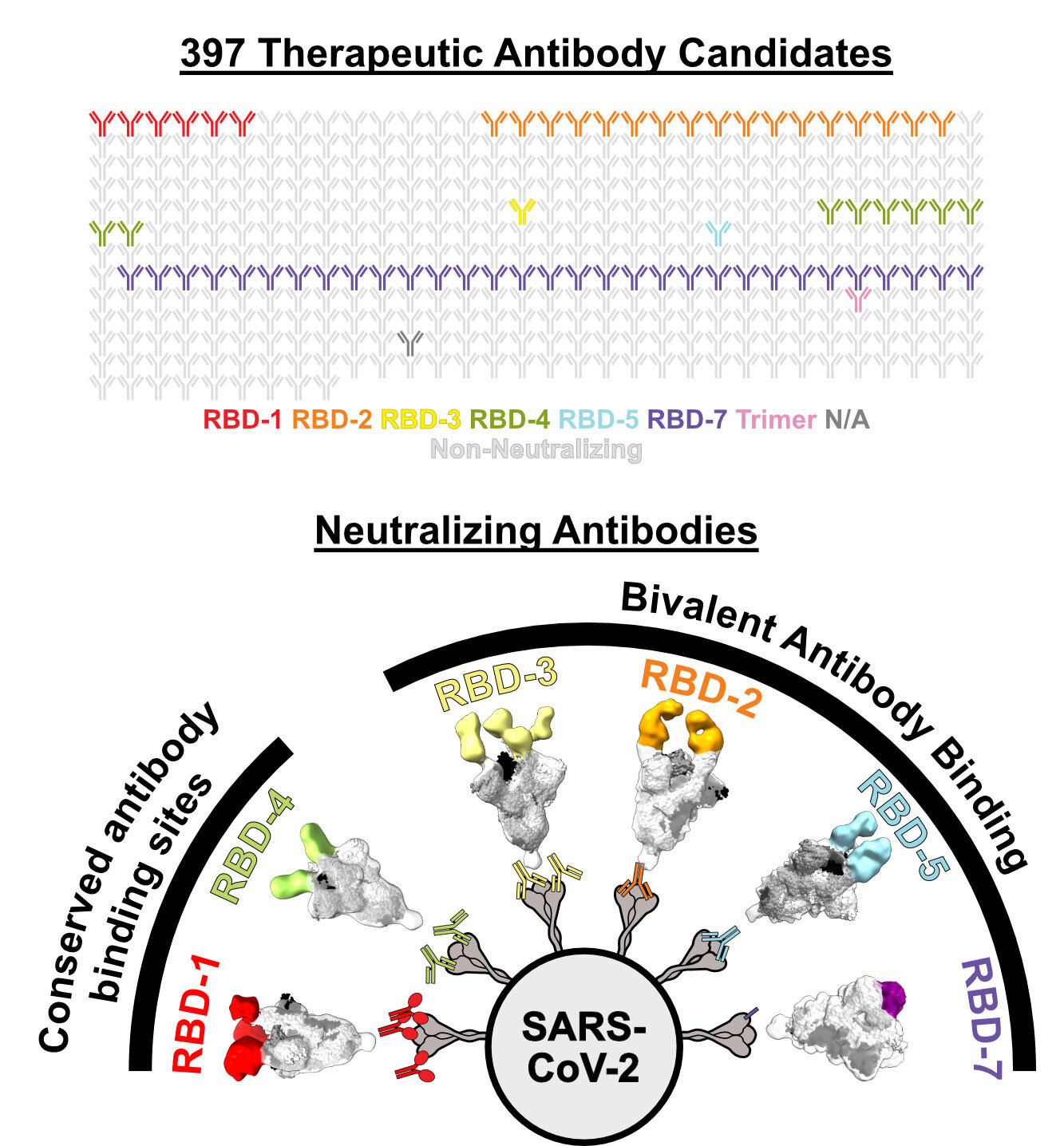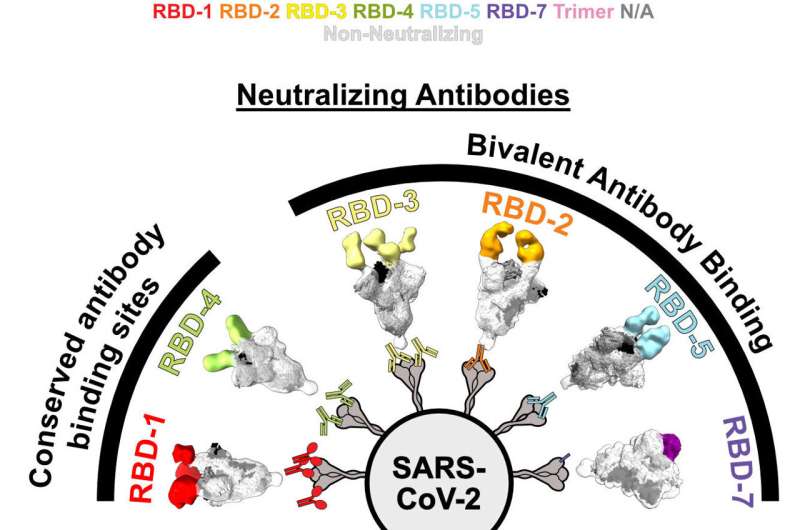
Los investigadores agruparon los anticuerpos en comunidades (consulte los grupos codificados por colores arriba) en función de dónde se dirigen los anticuerpos al RBD. El nuevo estudio destaca cómo algunas comunidades mantienen su poder neutralizador contra el linaje BA.1 de Omicron. Crédito: Saphire Lab, LJI
Un nuevo estudio dirigido por científicos del Instituto de Inmunología de La Jolla (LJI) muestra cómo los anticuerpos ideales contra el SARS-CoV-2 dan en el blanco.
Así es: marcas. En lugar de apuntar a un solo sitio de unión en la proteína Spike del SARS-CoV-2, estos poderosos anticuerpos se unen a dos de estos sitios a la vez. A través de esta unión «bivalente», los anticuerpos pueden bloquear estructuras virales clave en su posición, evitando que el virus infecte las células huésped.
Los nuevos hallazgos, publicados en Informes de celda, sugieren que los anticuerpos bivalentes conservan la eficacia contra las variantes tempranas del SARS-CoV-2 y varias variantes omicron posteriores. Ahora, los científicos están analizando cómo podríamos aprovechar su poder en nuevas terapias de anticuerpos y vacunas COVID-19 aún más efectivas.
«Los anticuerpos ideales existen», dice Kathryn Hastie, Ph.D., instructora de LJI y directora del Centro de Descubrimiento de Anticuerpos en LJI. Hastie dirigió el nuevo estudio junto con la investigadora posdoctoral de LJI, Heather Callaway, Ph.D., Sharon Schendel, Ph.D., y la presidenta y directora ejecutiva de LJI, Erica Ollmann Saphire Ph.D. «Ahora la pregunta es, ¿cómo potenciamos preferentemente esos?»
La nueva investigación fue posible gracias al Consorcio de Inmunoterapia de Coronavirus (CoVIC), un esfuerzo global con Saphire como Director y Schendel como Gerente de Programa.
Anticuerpos frente a omicron
Las vacunas actuales contra el COVID-19 están diseñadas para enseñarle al cuerpo a reconocer la proteína Spike del SARS-CoV-2. Spike es importante porque reconoce y se adhiere a las células huésped a través de una región llamada dominio de unión al receptor (RBD). Cada pico tiene tres copias del RBD. Un anticuerpo que puede unirse a un objetivo (llamado epítopo) en el RBD tiene la posibilidad de atascar esta maquinaria y detener la infección.
El problema es que el SARS-CoV-2 sigue mutando y muchos anticuerpos que alguna vez fueron poderosos no pueden reconocer sus objetivos habituales en los RBD. La creación de vacunas y terapias que resistan variaciones futuras depende de descubrir qué tienen en común los anticuerpos supervivientes.
Callaway y Hastie analizaron casi 400 anticuerpos enviados por científicos de todo el mundo al CoVIC, que tiene su sede en LJI. Redujeron este enorme grupo y encontraron 66 anticuerpos potentes que podrían neutralizar el linaje omicron BA.1 y los primeros sublinajes como BA.1.1 y BA.2. Cuando probaron los anticuerpos contra los linajes omicron BA.4/5, solo siete anticuerpos tenían poder neutralizante.
El problema era que estos anticuerpos sobrevivientes apuntaban al mismo lugar que otros anticuerpos que no resistieron las mutaciones en omicron. Era hora de ver cómo este grupo único de anticuerpos neutralizantes estaba haciendo el trabajo. Callaway utilizó una técnica de imagen llamada microscopía crioelectrónica y análisis bioquímico para ver exactamente cómo se unen estos anticuerpos a las moléculas en el RBD.
«Quedó claro que había un patrón», dice Callaway. «Los anticuerpos exitosos superan la pérdida de afinidad por omicron uniendo simultáneamente dos RBD en el Spike».
Los mejores anticuerpos neutralizantes colgaban de ambas manos. No unieron sus objetivos, uno a la vez, especialmente fuerte, pero al unir dos RBD adyacentes a la vez, incluso omicron tuvo dificultades para escapar. La unión bivalente igualó la supervivencia de los anticuerpos frente a las últimas variantes.
Una mirada más cercana a los anticuerpos bivalentes
La estructura básica de un anticuerpo se asemeja a la letra Y. Los dos brazos en la parte superior de la Y se denominan regiones de unión al antígeno del fragmento (Fab). Los dos Fab en cada anticuerpo tienen la misma estructura molecular y los Fab funcionan como llaves que buscan un candado (un epítopo).
Los científicos que realizan análisis estructurales de cómo los anticuerpos se unen a las proteínas a menudo usan solo la región Fab, y las imágenes en los libros de texto se han centrado en cómo los Fab individuales se unen a sitios únicos. El nuevo estudio sugiere que este enfoque anterior puede dar lugar a impresiones equivocadas.
En cambio, el equipo de LJI ha demostrado la importancia de obtener imágenes del anticuerpo intacto y completo tal como existe en la naturaleza, un tipo de análisis que solo es posible con microscopios electrónicos nuevos y potentes. Al hacerlo, el equipo pudo distinguir lo que sobrevivió frente a lo que quedó en el camino tras la aparición de omicron. Los anticuerpos que usan ambos brazos para anclar dos RBD a la vez resistieron la evolución viral.
En el futuro, los investigadores continuarán probando el grupo de anticuerpos CoVIC contra las nuevas variantes del SARS-CoV-2. Esta información es esencial para el desarrollo de mejores vacunas, que provocarán una inmunidad que dure varias temporadas de evolución viral. El laboratorio Saphire también está diseñando tales inmunógenos que retendrán una amplia actividad a lo largo del tiempo.
El poder de CoVIC
El hecho mismo de que los investigadores pudieran analizar un amplio grupo de casi 400 anticuerpos ha sido un gran paso adelante para la ciencia.
Como explica Saphire, el amplio alcance del panel de anticuerpos CoVIC que comprende cientos de candidatos terapéuticos aportados por más de 60 grupos en entornos corporativos y académicos, combinado con comparaciones en paralelo utilizando una variedad de técnicas, reveló suficiente de esta población de anticuerpos raros. para explicar qué características los hacían especiales.
«La escala del estudio permitió al equipo estudiar suficientes ‘sobrevivientes’ de omicron para encontrar reglas generales sobre lo que los hizo exitosos», dice Saphire.
«CoVIC demostró que la colaboración que permite estudios a mayor escala puede conducir a mejores conocimientos», agrega Schendel.
Schendel dice que tener tanto a la compañía de biotecnología con sede en Salt Lake City Carterra como al laboratorio de la profesora Georgia Tomaras, Ph.D., en la Universidad de Duke como laboratorios de referencia asociados en el CoVIC fue especialmente importante para clasificar los diferentes anticuerpos neutralizantes en anticuerpos de unión al epítopo. «comunidades», en función de dónde apuntan al SARS-CoV-2.
Aprender más sobre estos anticuerpos puede guiar la creación de cócteles de anticuerpos de próxima generación que sean más resistentes a las variantes del SARS-CoV-2 cada vez más emergentes.
En el futuro, será importante saber si los anticuerpos prometedores compiten entre sí o se complementan entre sí. Los investigadores de LJI también dicen que es fundamental observar cómo las nuevas vacunas presentan la proteína Spike al sistema inmunitario. Cuanto más precisa sea la versión del inmunógeno de Spike, y cuanto más precisamente presente la disposición y el espaciado de las partes componentes, más probable es que provoque anticuerpos neutralizantes.
«Realmente necesitamos pensar en preservar el pliegue, la geometría y la apariencia general de la proteína Spike», dice Schendel.
Más información:
Heather M. Callaway et al, Bivalent intra-spike binding proporciona durabilidad contra linajes Omicron emergentes: Resultados de un consorcio global, Informes de celda (2023). DOI: 10.1016/j.celrep.2023.112014. www.cell.com/cell-reports/full … 2211-1247(23)00025-6
Citación: Los anticuerpos duraderos contra el SARS-CoV-2 se unen a dos objetivos virales a la vez (17 de enero de 2023) consultado el 17 de enero de 2023 en https://medicalxpress.com/news/2023-01-durable-sars-cov-antibodies-viral. html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.