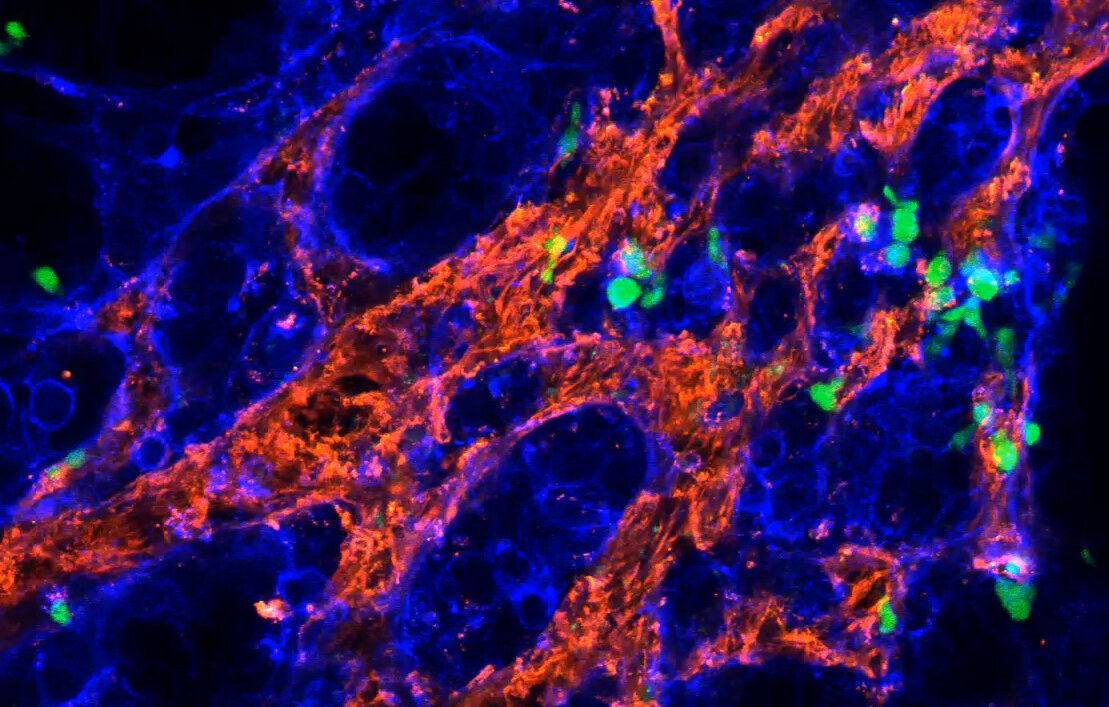
Imagen de microcopia de fluorescencia de células T gamma delta (verde) atacando células cancerosas (azul). Para llegar a las células cancerosas, las células inmunitarias necesitan navegar a través de una densa matriz extracelular que rodea el tejido tumoral (rojo). Crédito: Katrin Raute / Universidad de Friburgo
El cáncer de mama triple negativo (TNBC) es la forma más agresiva y mortal de cáncer de mama con opciones de tratamiento limitadas y una alta probabilidad de recurrencia. El crecimiento tumoral y la recaída de TNBC están impulsados por las células madre del cáncer de mama, y se necesitan con urgencia terapias mejoradas que puedan eliminar esas células resistentes.
Investigadores de la Universidad de Friburgo han descubierto que la diferenciación coordinada y los cambios en el metabolismo de las células madre del cáncer de mama las hacen invisibles para el sistema inmunitario. Contrarrestar el cambio metabólico con el fármaco zolendronato podría hacer que la inmunoterapia con células T gamma delta sea más eficaz contra el TNBC.
El equipo de investigación estuvo dirigido por la Prof. Dra. Susana Minguet del Clúster de Excelencia CIBSS—Centro de Estudios Integrativos de Señalización Biológica de la Universidad de Freiburg, en colaboración con el Dr. Jochen Maurer del Hospital Universitario RWTH Aachen, el Dr. Mahima Swamy de la Universidad de Dundee/Escocia y colaboradores del University Hospital Freiburg. El estudio fue publicado en la revista Investigación en inmunología del cáncer.
Las células TNBC se esconden de las células T gamma delta
Las células T gamma delta reconocen y eliminan las células que producen moléculas inducidas por estrés y fosfoantígenos, una característica común de las células cancerosas. Debido a que las células T gamma delta funcionan de manera diferente a otros tipos de células T, se están investigando como una alternativa a las inmunoterapias existentes. En el estudio actual, los investigadores probaron el efecto de las células T gamma delta en TNBC utilizando células cancerosas aisladas y un modelo de ratón desarrollado recientemente que replica de cerca las propiedades tumorales encontradas en pacientes humanos.
Si bien las células T gamma delta funcionaron bien contra las células madre aisladas de cáncer de mama de los pacientes, tuvieron un efecto mucho más débil en el modelo de ratón. Esto se debió a las adaptaciones de las células cancerosas que les permitieron pasar desapercibidas para el sistema inmunológico, encontraron los investigadores.
Estas adaptaciones incluyeron la regulación a la baja de la llamada vía del mevalonato: una vía metabólica que conduce a la producción de fosfoantígenos, una de las clases de moléculas que reconocen las células T gamma. Es probable que este mecanismo de escape también ocurra en pacientes con TNBC: el análisis de las bases de datos públicas de pacientes mostró que la expresión reducida de moléculas clave de la vía del mevalonato se correlaciona con un peor pronóstico.

El mandala representa artísticamente los hallazgos de la investigación: el círculo colorido representa una célula madre del cáncer de mama (BCSC) cuyas estructuras superficiales pueden ser reconocidas y eliminadas por las células T gamma delta. Los patrones grises ilustran los BCBC que tienen diferenciación concertada y escape inmunitario, permaneciendo invisibles para las células inmunitarias. Crédito: Susana Minguet / CIBSS, BIOSS, Universidad de Friburgo
La evasión inmune de las células TNBC es reversible
Este mecanismo de escape recientemente descubierto puede contrarrestarse con el fármaco zolendronato, que está aprobado por la FDA para el tratamiento de la osteoporosis y la metástasis ósea. Cuando los investigadores trataron las células escapistas con zolendronato, las células gamma T se volvieron mucho más eficientes para eliminar el cáncer.
«Nuestros hallazgos explican por qué los ensayos clínicos actuales que utilizan células T gamma delta no están teniendo el éxito esperado», dice Minguet. «Encontramos un posible enfoque farmacológico para revertir el escape inmunitario, que allana el camino para nuevas inmunoterapias combinatorias para el cáncer de mama triple negativo».
Más información:
Katrin Raute et al, tumores derivados de células madre del cáncer de mama escapan de la inmunovigilancia in vivo de células T γδ mediante la modulación de ligandos de células T γδ, Investigación en inmunología del cáncer (2023). DOI: 10.1158/2326-6066.CIR-22-0296
Citación: Las células T gamma delta pueden combatir el cáncer de mama agresivo (4 de mayo de 2023) recuperado el 4 de mayo de 2023 de https://medicalxpress.com/news/2023-05-gamma-delta-cells-aggressive-breast.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.