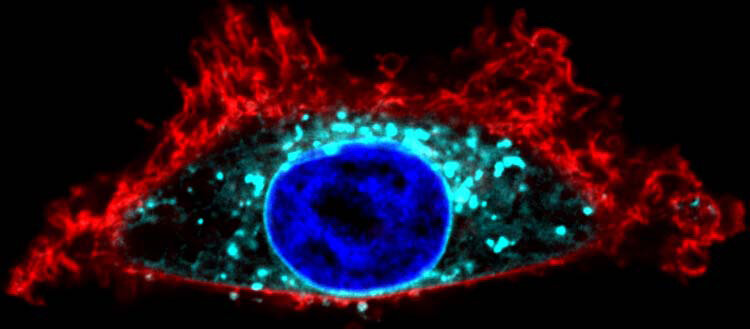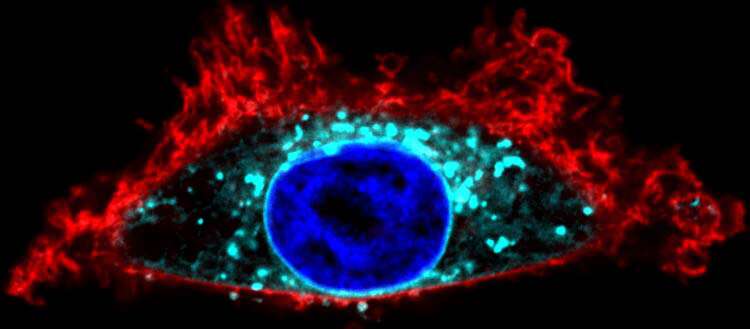
Visualización con la herramienta SwissKASH de una célula HeLa de la línea celular. La proteína Gαo (en turquesa) se recluta en la membrana del núcleo (en azul). Crédito: Gonzalo Solís / UNIGE
Las proteínas de membrana periférica se unen temporalmente a las membranas celulares, paso necesario para que puedan cumplir su función biológica. Para ello, entran en acción determinadas enzimas que catalizan su modificación lipídica. Este proceso se llama palmitoilación. Algunas de estas proteínas pueden mutar y volverse oncogénicas, como las proteínas RAS, que son responsables de aproximadamente un tercio de los cánceres.
Para comprender cómo funciona la palmitoilación y utilizarla con fines terapéuticos, científicos de la Universidad de Ginebra (UNIGE), Suiza, desarrollaron una herramienta novedosa para visualizar este proceso en células vivas. Han demostrado que, contrariamente a lo que se pensaba, la palmitoilación es posible no solo en el aparato de Golgi, el sitio habitual para el procesamiento y suministro de proteínas, sino también en el mismo sitio donde la proteína debe actuar, por ejemplo, la membrana plasmática. Este descubrimiento, publicado en la revista Comunicaciones de la naturalezaallana el camino hacia estrategias innovadoras de descubrimiento de fármacos para atacar con mucha precisión la unión a la membrana y, por lo tanto, la actividad de las proteínas oncogénicas.
La palmitoilación consiste en la introducción de ácidos grasos en determinadas proteínas para que puedan unirse a las membranas celulares. Este mecanismo se rige por reglas precisas, que dependen de la secuencia de cada tipo de proteína y de la presencia de enzimas especializadas. Hasta ahora, la comunidad científica creía que la palmitoilación de las proteínas de la membrana periférica solo podía tener lugar en un lugar de la célula, el aparato de Golgi.
“Efectivamente, estas proteínas se producen en el citosol —el líquido celular— y luego ‘nadan’ hasta el aparato de Golgi, donde se modifican antes de ser transportadas al lugar donde deben actuar”, explica Gonzalo Solís, investigador del Departamento de Ciencia Celular. Fisiología y Metabolismo de la Facultad de Medicina de la UNIGE, y autor principal de este trabajo. “Sin embargo, planteamos la hipótesis de la posibilidad de una palmitoilación local, sin pasar por el aparato de Golgi. Si esto es cierto, abre posibilidades completamente nuevas para la intervención de este mecanismo”.
Observación y manipulación de proteínas.
Para probar esta hipótesis, el equipo de investigación dirigido por Vladimir Katanaev, profesor en el Departamento de Fisiología Celular y Metabolismo y en el Centro de Investigación Traslacional en Onco-Hematología de la Facultad de Medicina de UNIGE, se centró en una proteína llamada Gαo, que normalmente es Localizado en la membrana plasmática y el aparato de Golgi.
La metodología utilizada es completamente nueva: “Llevamos las enzimas palmitoilantes a un compartimento totalmente diferente de la célula, la membrana nuclear”, explica Gonzalo Solis. «Gαo se reclutó en la membrana nuclear, lo que nos permitió identificar la enzima específica que los palmitoila. Por lo tanto, confirmamos que este proceso puede tener lugar en el mismo sitio donde se necesita la proteína».
Contrariamente a las metodologías bioquímicas habituales, la herramienta desarrollada por Vladimir Katanaev y su equipo, a la que llamaron SwissKASH, también es la primera en mantener viva la célula y permite observar el proceso de forma dinámica. «Hasta ahora, no había otra alternativa que destruir la célula», dice Vladimir Katanaev. «Nuestro método también permite determinar exactamente qué proteína reacciona localmente a qué enzima, lo cual es esencial si queremos controlar este mecanismo con fines terapéuticos».
Un nuevo objetivo farmacológico
Varias proteínas de membrana periférica, y en particular las proteínas de la subunidad Gα y las proteínas RAS, son susceptibles de mutación y, por lo tanto, adquieren un potencial oncogénico agresivo. Su oncogenicidad depende de su capacidad para unirse a la membrana plasmática; La palmitoilación juega así un papel clave en la transformación de una célula sana en cancerosa.
“Inhibir la enzima que induce la palmitoilación y evitar que la proteína oncogénica se una a la membrana plasmática podría, por tanto, desactivar su patogenicidad”, dice Gonzalo Solís. «Por lo tanto, podemos imaginar el bloqueo de esta reacción específica sin desequilibrar todo el sistema». Los científicos ahora intentarán automatizar esta metodología para estudiar el efecto de toda una serie de productos farmacéuticos en la palmitoilación de oncoproteínas seleccionadas, así como probar su toxicidad en toda la célula.
Gonzalo P. Solis et al, La palmitoilación S local y específica del sustrato determina la localización subcelular de Gαo, Comunicaciones de la naturaleza (2022). DOI: 10.1038/s41467-022-29685-8
Citación: Palmitoylation, un nuevo objetivo para los medicamentos contra el cáncer (25 de abril de 2022) consultado el 25 de abril de 2022 en https://medicalxpress.com/news/2022-04-palmitoylation-anti-cancer-drugs.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.