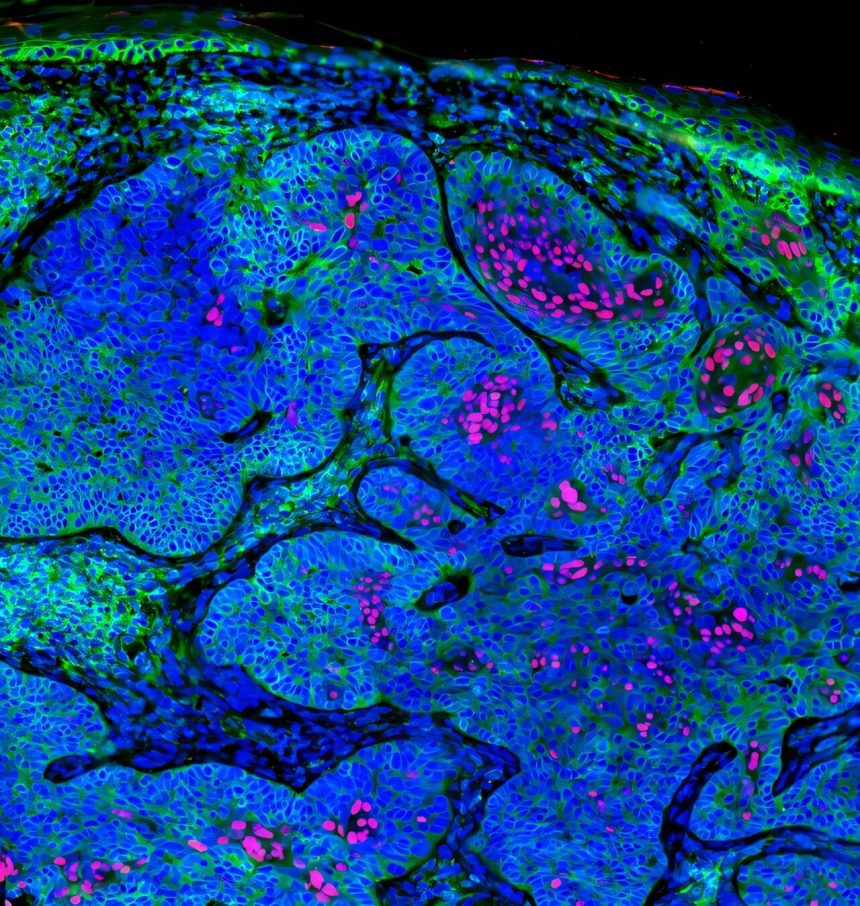
El carcinoma de células basales tiene baja inmunogenicidad. Las células tumorales expresan la proteína FoxC1 (rojo), que suprime HLA Clase I (verde) en las células tumorales. Crédito: Shawn Demehri, Hospital General de Massachusetts
La presentación de antígeno comprometido se ubica entre los principales mecanismos que hacen que los cánceres no inmunogénicos (no respondieran a las terapias basadas en inmunes). A pesar de albergar la carga mutacional tumoral más alta de todos los cánceres, los carcinomas de células basales (BCC) tienen baja inmunogenicidad.
La pérdida de los antígenos de leucocitos humanos de los componentes de clase I (HLA-I) es particularmente frecuente en los cánceres de intercambio inmune.
Los antígenos tumorales se capturan y muestran mediante procesamiento de antígeno y maquinaria de presentación (APM) en la superficie celular por HLA-I, lo que hace posible para CD8+ + Células T para eliminar las células cancerosas. Sin embargo, las células cancerosas han desarrollado varios medios para limitar la APM y evadir el reconocimiento inmune.
Shawn DeMehri, MD, Ph.D., un médico-investigador en el Centro de Investigación de Biología Cutánea y el Centro de la Familia Krantz para la Investigación del Cáncer en el Hospital General de Massachusetts y profesor asociado de dermatología en la Escuela de Medicina de Harvard, es el autor senior de un estudio en Informes celularestitulada «La regulación epigenómica de la semilla contribuye a la baja inmunogenicidad del cáncer humano más mutado».
Para determinar el estado inmune de BCC, el equipo de investigación de Demehri estudió una gran colección de BCC humanos primarios en comparación con los carcinomas de células escamosas (SCC), que han demostrado más receptivas a las terapias inmunes. Descubrieron que los BCC primarios tenían un fenotipo de intercambio inmune asociado con una expresión mínima de HLA-I por células cancerosas, incluso durante su desarrollo temprano.
Los investigadores también determinaron que un programa inactivo similar a STEM que persistió de la célula de origen del tumor suprimió los genes APM en las células BCC, y que la reversión epigenómica de la supresión de genes APM habilitó la inmunoterapia con BCC.
Estos hallazgos revelan la célula de origen como el determinante dominante de la inmunogenicidad del cáncer en los BCC y apuntan a un nuevo enfoque que podría mejorar el tratamiento.
El carcinoma de queratinocitos, incluidos los BCC y los SCC cutáneos, es el cáncer más común con un aumento continuo en la incidencia.
Los SCC muestran una tasa de respuesta objetiva del 49.3% a la terapia PD-1, mientras que el BCC metastásico tiene solo una terapia ORR al PD-1 del 21%.
Los receptores de trasplante de órganos en inmunosupresores sistémicos tienen un riesgo más de 100 veces mayor de SCC en comparación con la población general, pero solo un riesgo de seis a 16 veces mayor de BCC, lo que sugiere que BCC puede carecer de inmunogenicidad.
Demehri explica: «Para determinar el estado inmune de BCC, estudiamos una gran colección de BCC humanos primarios en comparación con los SCC. Aunque las células T eran detectables en el estroma que rodeaba el BCC, significativamente menos CD4+ + y CD8+ + Las células T infiltradas en focos tumorales BCC en comparación con los SCC. Una encuesta de otras células inmunes encontró que también se redujeron significativamente en BCC en comparación con SCC.
«La secuenciación de ARN de células individuales en muestras de BCC y SCC recolectadas con métodos de preparación de células similares mostró poblaciones de células inmunes mucho más pequeñas en BCC en comparación con SCC. Estos hallazgos indican que el BCC primario tiene un fenotipo inmunomunealizado, lo que conduce a una baja inmunogenicidad de BCC en comparación con el ‘SCC infiltrado inmunitario’ inmunitario.
«Es importante destacar que BCC temprano con células T raras en el estroma mostró una baja expresión de HLA-I, lo que indica que los niveles bajos de APM en BCC se originan a partir de un mecanismo intrínseco integral a su biología del desarrollo.
«También encontramos que FOXC1 es un supresor crítico de IRF1 y HLA-I en células BCC, que recuerda a su función en las células madre del folículo piloso inactivo. FoxC1 regula a la baja la expresión de IRF1 y HLA-I por mecanismos epigenómicos, que se pueden invertir para determinar la inmunoterapia con BCC».
Implicaciones clínicas
«Demostramos que el tratamiento tópico entinostat regula la presentación de antígeno en BCC in vivo», continúa DeMehri. «Como tal, combinar entinostat con inmunoterapia tópica y sistémica es clave para habilitar la inmunoterapia con BCC.
«Para lograr esto, combinamos Entinostat tópico con una inmunoterapia tópica aprobada por la FDA, imiquimod. La alta eficacia del entinostat más imiquimod para suprimir el desarrollo de BCC indica que la expresión de APM inducida por Entinostat en las células de cáncer de BCC sinergia con la activación de células inmunes por imiquimod a ELIMINADO BCC in VivO.
«Según nuestros hallazgos, se justifica un primer ensayo clínico en humano para investigar la eficacia de esta terapia combinada para el tratamiento con BCC en humanos».
Más información:
Tomonori Oka et al, la regulación epigenómica de la taladura contribuye a la baja inmunogenicidad del cáncer humano más mutado, Informes celulares (2025). Doi: 10.1016/j.celrep.2025.115561
Citación: La baja inmunogenicidad del carcinoma de células basales vinculada a la supresión de la presentación de antígeno de su célula de origen (2025, 22 de abril) Recuperó el 22 de abril de 2025 de https://medicalxpress.com/news/2025-04-basal-carcinoma-inmunogenicidad-linking.html
Este documento está sujeto a derechos de autor. Además de cualquier trato justo con el propósito de estudio o investigación privada, no se puede reproducir ninguna parte sin el permiso por escrito. El contenido se proporciona solo para fines de información.