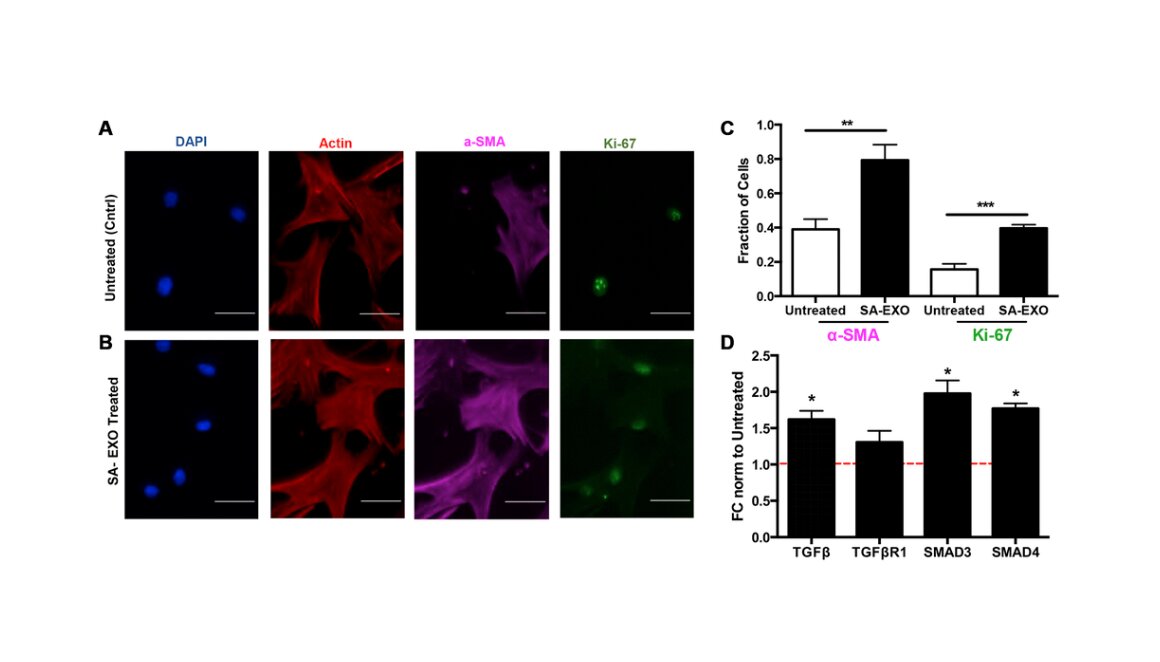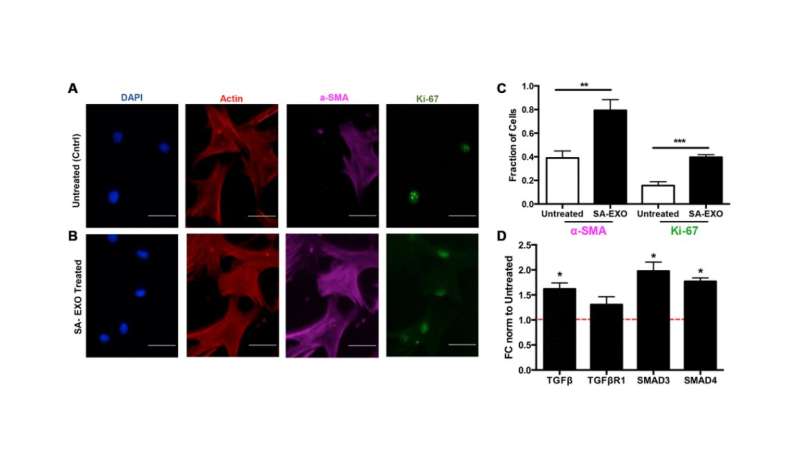
El intercambio EXO Senescente promueve el fenotipo MSC activado. Crédito: 2023 Lee et al.
Se publicó en Envejecimiento.
La fibrosis inducida por radiación es un efecto secundario común de la radioterapia, que es el tratamiento más común para el cáncer. Sin embargo, la radiación también provoca la detención del ciclo celular mediada por p53, la expresión prolongada de p21 y el desarrollo de la senescencia en las células normales que residen en los tejidos irradiados. Las células madre mesenquimales (MSC) derivadas de la médula ósea se acumulan en los sitios del tumor primario debido a su tropismo natural por los tejidos inflamatorios y fibróticos.
Las MSC son extremadamente sensibles a dosis bajas de radiación ionizante y adquieren senescencia como resultado de los efectos de la radiación de los espectadores. Las células senescentes permanecen metabólicamente activas pero desarrollan un potente fenotipo secretor asociado a la senescencia (SASP) que se correlaciona con la secreción hiperactiva de citocinas, factores de crecimiento profibróticos y exosomas (EXO).
El análisis de la vía integradora ha destacado que la senescencia inducida por la radiación enriqueció significativamente el ciclo celular, la matriz extracelular, la señalización del factor de crecimiento transformante-β (TGF-β) y los genes de transporte mediado por vesículas en las MSC. Los EXO son nanovesículas secretadas por células (una subclase de pequeñas vesículas extracelulares) que contienen biomateriales (proteínas, ARN, microARN (miARN)) que son fundamentales en la comunicación entre células. El análisis del contenido de miARN de los EXO secretados reveló además que la senescencia inducida por la radiación alteró de forma única los perfiles de miARN.
«De hecho, varios de los miARN destacados se dirigieron directamente a TGF-β o genes aguas abajo», escriben los investigadores.
En este nuevo estudio, los investigadores Amy H. Lee, Deepraj Ghosh, Ivy L. Koh y Michelle R. Dawson de la Universidad de Brown trataron las MSC normales con EXO asociadas a la senescencia (SA-EXO) para examinar los efectos de la senescencia inducida por la radiación en los espectadores. .
Los investigadores encontraron que estos genes modulados estaban relacionados con la vía del TGF-β y elevaban tanto la actina del músculo liso alfa (proteína aumentada en células senescentes activadas) como la expresión de Ki-67 (marcador proliferativo) en las MSC tratadas con SA-EXO en comparación con las MSC no tratadas. Revelaron que los SA-EXO poseen un contenido de miARN único que influye en los fenotipos de miofibroblastos a través de la activación de la vía TGF-β. Esto destaca que los SA-EXO son potentes factores SASP que desempeñan un papel importante en la fibrosis relacionada con el cáncer.
«Nuestros análisis de micromatrices EXO y ómica integrados muestran que las CMM senescentes poseen genes transcripcionales diferenciales y secretan vesículas que contienen una carga postranscripcional única. Posteriormente demostramos que estos miARN EXO pueden desempeñar funciones importantes en la comunicación célula-célula durante la progresión de la enfermedad», concluye el autores
Más información:
Amy H. Lee et al, Los exosomas asociados a la senescencia transfieren la fibrosis inducida por miARN a las células vecinas, Envejecimiento (2023). DOI: 10.18632/envejecimiento.204539
Proporcionado por Impact Journals
Citación: Estudio: Los exosomas asociados a la senescencia transfieren fibrosis a las células vecinas (2023, 17 de marzo) recuperado el 17 de marzo de 2023 de https://medicalxpress.com/news/2023-03-senescence-associated-exosomes-fibrosis-neighboring-cells.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.