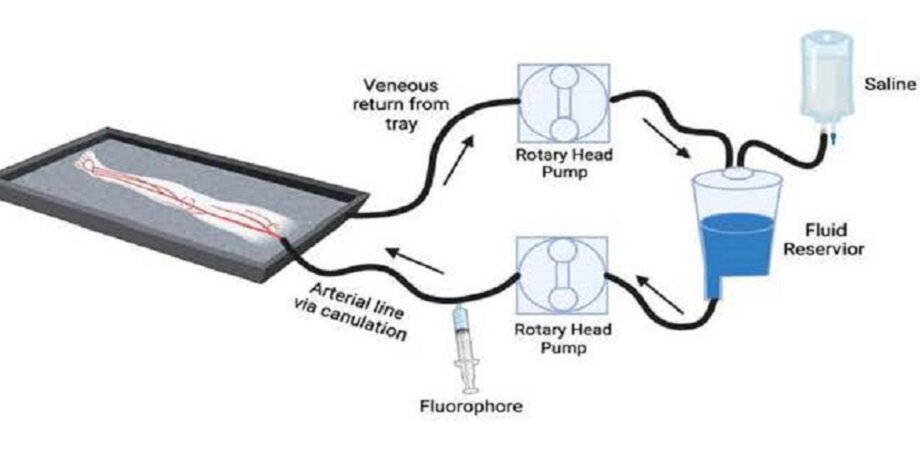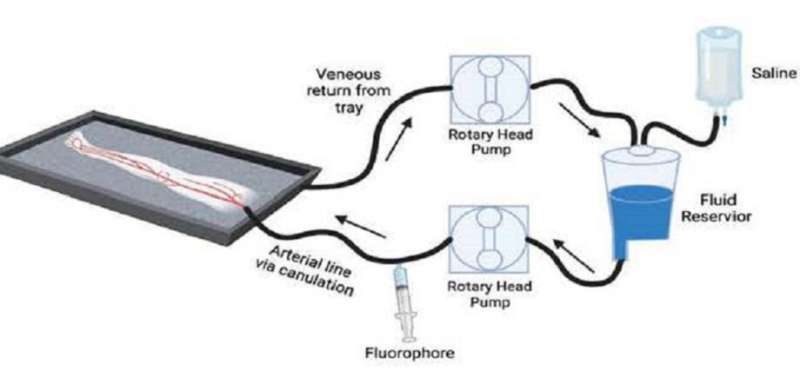
Perfusión de una extremidad amputada con solución salina y un agente fluorescente (es decir, fluoróforo) administrados a través de una arteria dominante. La solución salina y el fluoróforo dirigido entraron a través de la arteria, la extremidad se drenó por gravedad y el perfundido se recicló nuevamente al circuito. Crédito: Revista de óptica biomédica (2023). DOI: 10.1117/1.JBO.28.8.082802
El campo naciente de la cirugía guiada por fluorescencia (FGS) está creciendo rápidamente, con el potencial de mejorar enormemente la seguridad y la eficacia de los procedimientos quirúrgicos. En FGS, los tejidos de interés se identifican y marcan utilizando moléculas especiales llamadas fluoróforos. La función principal de estos fluoróforos es distinguir el tejido objetivo de otros tejidos y, posteriormente, guiar los pasos quirúrgicos.
La lista actual de fluoróforos aprobados por la FDA para uso clínico se limita a tres: verde de indocianina (ICG), fluoresceína y azul de metileno (MB). Si bien estos agentes tienen varias aplicaciones clínicas, no están dirigidos, lo que limita su especificidad. La creciente demanda de FGS ha incentivado la identificación de nuevos fluoróforos específicos que se dirigen a ciertos tejidos y prometen el éxito clínico. Aunque muchos fluoróforos candidatos parecen efectivos en modelos animales, su traducción clínica requiere pruebas rigurosas y una inversión financiera significativa. Un artículo reciente en Revista de óptica biomédica ha abordado este problema.
En este estudio, investigadores de los Estados Unidos desarrollaron un sistema novedoso y mejorado para identificar los agentes fluorescentes que tienen la mayor probabilidad de éxito clínico. «Comprender cómo funcionan estos fluoróforos en los tejidos humanos es vital para mejorar la precisión y la seguridad de los agentes fluorescentes y, en última instancia, reducir los costos de desarrollo y minimizar el daño potencial a los pacientes», dice Logan M. Bateman, autor principal del estudio.
Para reducir el tiempo en la selección de fluoróforos, los investigadores se asociaron con el Laboratorio Gibbs de la Universidad de Ciencias y Salud de Oregón. Juntos, desarrollaron un modelo de miembro inferior humano amputado para probar un fluoróforo específico del nervio. En este modelo, el examen de los tejidos se inicia poco después de la amputación, antes de la ruptura del tejido inducida por la falta de suministro de oxígeno. Usando una bomba cardíaca para perfundir solución salina, el equipo pudo imitar la presión vascular y osmótica que se observa en los tejidos humanos vivos.
Después de la amputación, las extremidades se transportan a un laboratorio quirúrgico, donde se perfunden con el fluoróforo objetivo mediante un circuito de recirculación. Primero, se perfunde solución salina a través de una arteria dominante y luego se administra una dosis estándar del fluoróforo LGW16-03 (específico del nervio). La extremidad se drena por gravedad y la perfusión recolectada se recicla nuevamente al circuito para imitar la circulación sanguínea. Esto ocurre durante 10 minutos de perfusión con el fluoróforo, seguido de un lavado de 20 minutos solo con solución salina. Después de 30 minutos, se obtienen imágenes del tejido nervioso, tanto in situ (dentro de la extremidad amputada) como ex vivo (aislado de la extremidad) utilizando sistemas de imágenes de fluorescencia de campo abierto y de campo cerrado.
Dado que el agente no es tóxico, el parámetro clave que determina su eficacia es su relación señal-fondo (SBR), un indicador de la fuerza de la señal deseada (es decir, la señal del tejido nervioso) en relación con el ruido de fondo. Sorprendentemente, el fluoróforo mostró un rendimiento excelente en este sentido.
«Estamos impresionados con el SBR visto con este fluoróforo y creemos que también tendrá un excelente desempeño clínico. Al ver estos valores de contraste, estamos seguros de que el modelo de perfusión está administrando adecuadamente el fluoróforo al tejido objetivo», comenta el autor principal Eric R. Henderson del Centro Médico Dartmouth-Hitchcock. Los resultados confirmaron que el agente tiene el rendimiento óptico necesario para resaltar el tejido objetivo y, lo que es más importante, demostraron la viabilidad de este nuevo modelo de extremidad humana amputada.
Entonces, ¿qué depara el futuro? El equipo cree que el modelo de extremidad humana podría usarse no solo para estudiar y seleccionar otros agentes fluorescentes en el futuro, sino también para estudiar enfermedades periféricas y características patológicas en tejidos bajo condiciones controladas. Además, el equipo también ve que la plataforma se aplica para estudiar los cambios causados por el crecimiento del tumor.
Henderson concluye: «Este es el primer modelo ex vivo de su tipo que hemos utilizado para examinar el rendimiento de este fluoróforo y, aunque se necesitan más pruebas, el modelo tiene un tremendo potencial para muchas aplicaciones diferentes en la investigación traslacional».
Logan M. Bateman et al, Evaluación preclínica de sondas fluorescentes dirigidas molecularmente en extremidades humanas amputadas perfundidas, Revista de óptica biomédica (2023). DOI: 10.1117/1.JBO.28.8.082802
Proporcionado por SPIE–Sociedad Internacional de Óptica y Fotónica
Citación: Primer modelo de extremidad humana amputada de su tipo para estudiar sondas de imágenes para tejidos humanos (6 de enero de 2023) consultado el 6 de enero de 2023 en https://medicalxpress.com/news/2023-01-first-of-its- kind-amputated-human-limb-imaging.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.