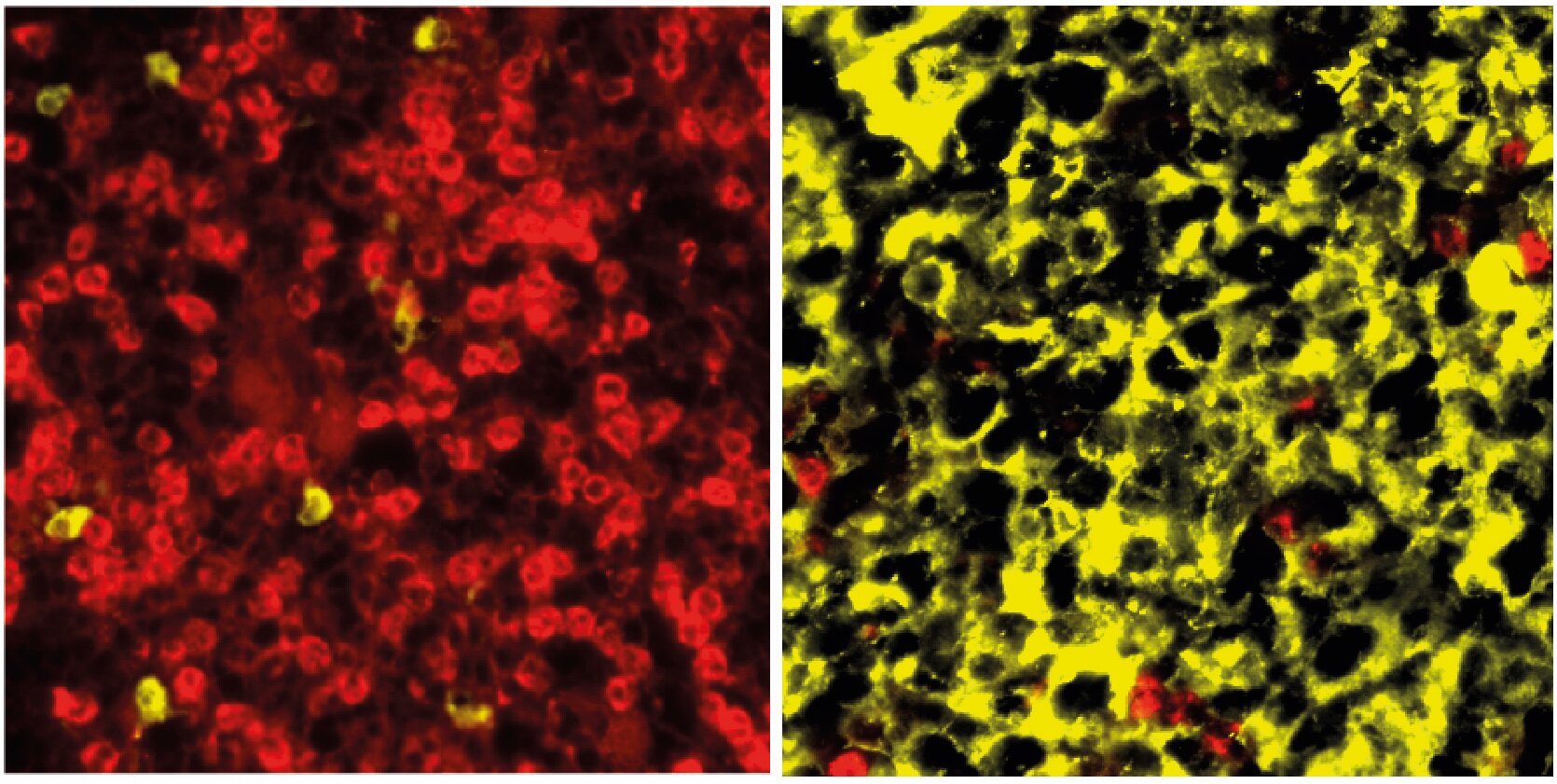
Izquierda: Médula ósea normal en los animales de control con células mieloides teñidas. Derecha: Médula ósea en los animales transgénicos con infiltración de células plasmáticas. Crédito: Janz/Mathas Lab, Centro Max Delbrück
Los linfocitos B, también conocidos simplemente como células B, desempeñan un papel central en el sistema inmunitario. Si los patógenos ingresan al cuerpo, las células B se activan y se convierten en células plasmáticas, que luego liberan anticuerpos. Un paso importante en este proceso es la reacción del centro germinal. Si se interrumpe la maduración de las células B en células plasmáticas, se puede desarrollar mieloma múltiple, uno de los cánceres de la sangre más comunes. Esta enfermedad tiene una variedad de subtipos y aún no es curable.
Los mielomas múltiples se desarrollan muy lentamente y en varias etapas. El proceso se inicia por aberraciones genéticas espontáneas que ocurren durante la reacción del centro germinal e influyen en el proceso de maduración de las células B. La etapa preliminar de la enfermedad se llama gammapatía monoclonal de significado indeterminado (MGUS), un precursor benigno que no causa síntomas.
El único biomarcador es una mayor concentración del anticuerpo secretado por las células plasmáticas en la sangre. Se necesitan más cambios genéticos en las células plasmáticas para que la línea entre MGUS y el cáncer maligno se cruce de forma irreversible.
Los modelos imitan exactamente la enfermedad humana.
Los modelos de ratón anteriores no han podido representar con precisión los diferentes subtipos genéticos de mieloma. Un equipo dirigido conjuntamente por el renombrado investigador de células B, el profesor Klaus Rajewsky, y el experto en linfomas, el Dr. Martin Janz, ha logrado precisamente eso. en el diario PNASpresentan nuevos modelos de ratón que replican con precisión dos subtipos de mieloma múltiple humano.
«También hemos podido demostrar que la interacción de varias aberraciones genéticas es un factor decisivo en el desarrollo de la enfermedad», dice Janz, jefe del Laboratorio de Biología de Linfomas Malignos del Centro de Investigación Clínica y Experimental (ECRC), un institución conjunta del Centro Max Delbrück y Charité—Universitätsmedizin Berlin.
Los investigadores comenzaron estableciendo tres grupos diferentes de ratones transgénicos, cada uno con una sola modificación genética: una copia adicional de los genes que codifican la ciclina D1, MMSET o Ikk2. La ciclina D1 regula la progresión del ciclo celular y la activación incorrecta de su gen codificante debido a una aberración promueve una mayor división celular. MMSET es una histona metiltansferasa que regula la accesibilidad del ADN.
La sobreexpresión de su gen codificante cambia profundamente el patrón epigenético de la célula y aumenta su susceptibilidad a sufrir una transformación maligna. Ikk2 activa un componente de la vía de señalización de NF-κB, que desempeña un papel importante en el crecimiento celular y la respuesta inmunitaria. La activación frecuente de esta cadena de señalización es una característica distintiva del mieloma múltiple.
El mieloma múltiple ocurre principalmente en la vejez
En un segundo paso, los científicos cruzaron ratones ciclina D1 y MMSET con ratones Ikk2 y seleccionaron la descendencia con los atributos genéticos deseados, es decir, ciclina D1 + Ikk2 y MMSET + Ikk2. Luego los emparejaron con otra cepa de ratón, lo que permitió que la información genética modificada se activara solo en las células B y solo como parte de la reacción del centro germinal.
«Fue sorprendente ver cómo la modificación principal en el modelo de ratón, a través de la sobreexpresión de ciclina D1 o MMSET, realmente da forma al perfil del subtipo de enfermedad», dice Rajewsky.
Los ratones experimentales tardaron de 70 a 90 semanas en desarrollar un mieloma múltiple completo, mucho tiempo en la vida de un ratón. Aunque esta línea de tiempo complica los experimentos, imita con precisión el desarrollo de la enfermedad en humanos: para nosotros, también, el mieloma múltiple tiende a surgir más tarde en la vida y, a menudo, lleva años progresar hasta la etapa maligna. Se estima que hasta el cinco por ciento de todas las personas mayores de setenta años tienen el precursor benigno MGUS.
«Nuestros modelos dejan en claro que el mieloma múltiple solo se desarrolla cuando ocurren varias aberraciones genéticas juntas», explica Janz. «Los ratones que solo eran transgénicos con respecto a la ciclina D1 o MMSET y que no portaban también Ikk2 modificado no desarrollaron la enfermedad».
Un importante punto de partida para futuras pruebas.
Aunque los síntomas son similares (niveles elevados de calcio, anemia, fatiga, mayor susceptibilidad a infecciones, insuficiencia renal, daño óseo), los subtipos de mieloma múltiple en humanos difieren en cuanto a la naturaleza de los cambios genéticos, los perfiles de expresión génica y el pronóstico.
«Nuestros modelos proporcionan una base importante para investigar las diferencias y similitudes entre los distintos subgrupos y nos ayudarán a desarrollar estrategias terapéuticas individualizadas más específicas a largo plazo», dice la Dra. Wiebke Winkler, autora principal del estudio.
Los investigadores ahora quieren usar los nuevos modelos de ratones para identificar los «talones de Aquiles genéticos» de los subgrupos, como dice Janz. Además, quieren activar las células B en los modelos animales de una forma aún más específica e introducir más modificaciones genéticas secundarias en el genoma del ratón. «Después de todo, Ikk2 no es el único impulsor de la enfermedad», destaca Janz.
Más información:
Wiebke Winkler et al, Modelos de ratón de subgrupos de mieloma múltiple humano, procedimientos de la Academia Nacional de Ciencias (2023). DOI: 10.1073/pnas.2219439120
Citación: El equipo genera con éxito modelos de ratón para dos subtipos de mieloma múltiple (16 de marzo de 2023) recuperado el 16 de marzo de 2023 de https://medicalxpress.com/news/2023-03-team-successfully-generates-mouse-subtypes.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.