Crédito: AA Riccio, NIEHS
Investigadores de los Institutos Nacionales de Salud han desarrollado una estructura tridimensional que les permite ver cómo y dónde las mutaciones de la enfermedad en la proteína centelleante pueden conducir a enfermedades mitocondriales. La proteína está involucrada en ayudar a las células a usar la energía que nuestros cuerpos convierten de los alimentos. Antes del desarrollo de esta estructura 3D, los investigadores solo tenían modelos y no pudieron determinar cómo estas mutaciones contribuyen a la enfermedad. Las enfermedades mitocondriales son un grupo de condiciones hereditarias que afectan a 1 de cada 5000 personas y tienen muy pocos tratamientos.
«Por primera vez, podemos mapear las mutaciones que causan varias de estas enfermedades devastadoras», dijo la autora principal, Amanda A. Riccio, Ph.D., e investigadora del ADN mitocondrial del Instituto Nacional de Ciencias de la Salud Ambiental (NIEHS). Grupo de replicación, que forma parte de los NIH. «Los médicos ahora pueden ver dónde se encuentran estas mutaciones y pueden usar esta información para ayudar a identificar las causas y ayudar a las familias a tomar decisiones, incluidas las decisiones sobre tener más hijos».
Los nuevos hallazgos serán particularmente relevantes para el desarrollo de tratamientos dirigidos a pacientes que padecen enfermedades mitocondriales como la oftalmoplejía externa progresiva, una afección que puede conducir a la pérdida de las funciones musculares involucradas en el movimiento de los ojos y los párpados; el síndrome de Perrault, un trastorno genético raro que puede causar pérdida de audición; ataxia espinocerebelosa de inicio infantil, un trastorno neurológico hereditario; y el síndrome de agotamiento del ADN mitocondrial hepatocerebral (ADNmt), una enfermedad hereditaria que puede provocar insuficiencia hepática y complicaciones neurológicas durante la infancia.
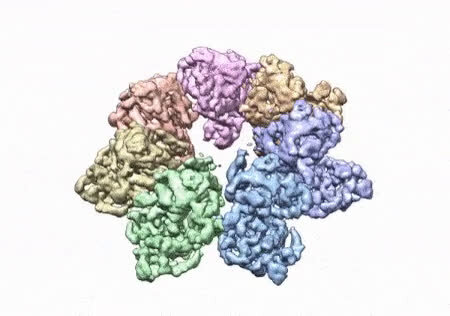
El papel que aparece en el procedimientos de la Academia Nacional de Ciencias muestra cómo los investigadores del NIEHS fueron los primeros en mapear con precisión variantes clínicamente relevantes en la helicasa centelleante, la enzima que desenrolla la doble hélice del ADN mitocondrial. La estructura centelleante y todas las coordenadas ya están disponibles en los datos abiertos Banco de datos de proteínas que está disponible gratuitamente para todos los investigadores.
«La estructura de Twinkle ha eludido a los investigadores durante muchos años. Es una proteína muy difícil de trabajar», señaló William C. Copeland, Ph.D., quien dirige el Grupo de replicación del ADN mitocondrial y es el autor correspondiente del artículo. «Al estabilizar la proteína y usar el mejor equipo del mundo, pudimos construir la última pieza que faltaba para el replisoma de ADN mitocondrial humano».
Los investigadores utilizaron microscopía crioelectrónica (CryoEM), que les permitió ver el interior de la proteína y las estructuras intrincadas de cientos de aminoácidos o residuos y cómo interactúan.
Las mitocondrias, que son responsables de la producción de energía, son especialmente vulnerables a las mutaciones. Las mutaciones del mtDNA pueden alterar su capacidad de generar energía de manera eficiente para la célula. A diferencia de otras estructuras especializadas en las células, las mitocondrias tienen su propio ADN. En el núcleo de una célula hay dos copias de cada cromosoma, sin embargo en la mitocondria puede haber miles de copias de mtDNA. Tener una gran cantidad de cromosomas mitocondriales permite que la célula tolere algunas mutaciones, pero la acumulación de demasiadas copias mutadas conduce a la enfermedad mitocondrial.
Para realizar el estudio, los investigadores utilizaron una mutación clínica, W315L, conocida por causar oftalmoplejía externa progresiva, para resolver la estructura. Usando CryoEM, pudieron observar miles de partículas de proteína que aparecían en diferentes orientaciones. La estructura final muestra una disposición circular multiproteica. También utilizaron espectrometría de masas para verificar la estructura y luego realizaron simulaciones por computadora para comprender por qué la mutación da como resultado la enfermedad.
En un abrir y cerrar de ojos, pudieron mapear hasta 25 mutaciones causantes de enfermedades. Descubrieron que muchas de estas mutaciones de enfermedades se mapean justo en la unión de dos subunidades de proteínas, lo que sugiere que las mutaciones en esta región debilitarían la forma en que interactúan las subunidades y harían que la helicasa no pudiera funcionar.
«La disposición de los centelleos se parece mucho a un rompecabezas. Una mutación clínica puede cambiar la forma de las piezas centelleantes, y es posible que ya no encajen correctamente para llevar a cabo la función prevista», explicó Riccio.
«Lo que es tan hermoso del trabajo del Dr. Riccio y del equipo es que la estructura permite ver muchas de estas mutaciones de enfermedades reunidas en un solo lugar», dijo Matthew J. Longley, Ph.D., autor e investigador del NIEHS. «Es muy inusual ver un artículo que explique tantas mutaciones clínicas. Gracias a este trabajo, estamos un paso más cerca de tener información que pueda usarse para desarrollar tratamientos para estas enfermedades debilitantes».
Amanda A. Riccio et al, Conocimiento estructural y caracterización de la helicasa Twinkle humana en la enfermedad mitocondrial, procedimientos de la Academia Nacional de Ciencias (2022). DOI: 10.1073/pnas.2207459119
Citación: Equipo de investigación primero en desarrollar la estructura 3D de la proteína centelleante (5 de agosto de 2022) recuperado el 6 de agosto de 2022 de https://phys.org/news/2022-08-team-3d-twinkle-protein.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.