Gráficamente abstracto. Crédito: JACC: Ciencia Básica a Traslacional (2022). DOI: 10.1016/j.jacbts.2022.01.001
Bajo estrés, el corazón humano se esfuerza por bombear sangre de manera eficiente a través del cuerpo. Con el tiempo, a medida que el corazón se esfuerza demasiado tratando de compensar esta pérdida de eficiencia, se producen cambios perjudiciales. El más preocupante de estos cambios es una forma de crecimiento desadaptativo conocida como hipertrofia cardíaca, que eventualmente conduce a insuficiencia cardíaca, una condición en la que el corazón pierde progresivamente su capacidad para bombear sangre.
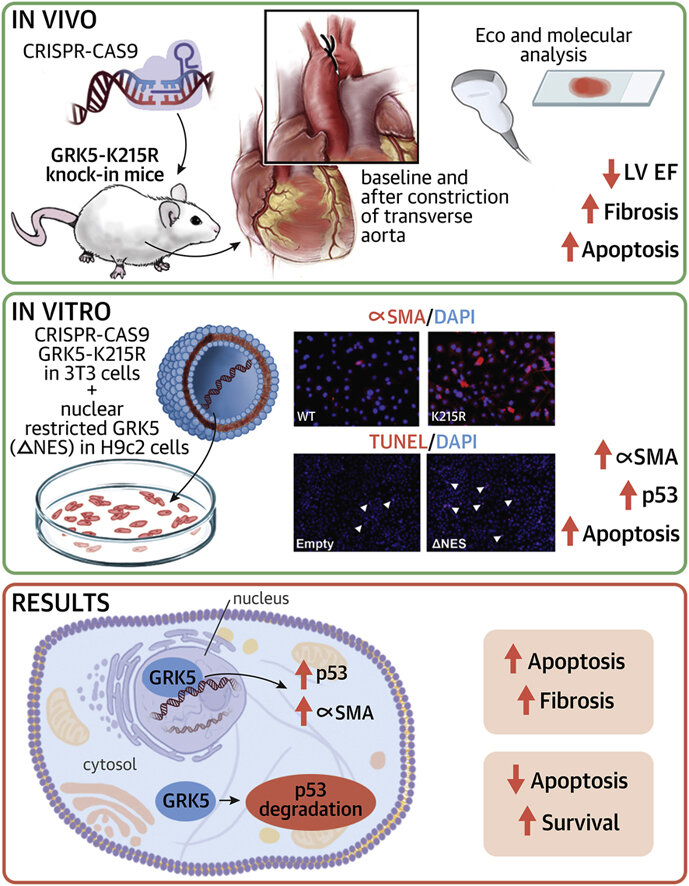
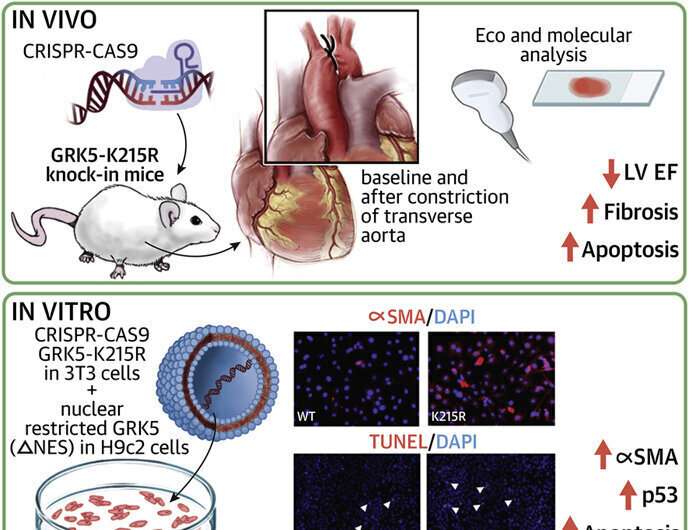
La tasa de supervivencia de los pacientes con insuficiencia cardíaca es baja, lo que genera la necesidad de nuevas estrategias terapéuticas. Ahora, los científicos de la Escuela de Medicina Lewis Katz de la Universidad de Temple están cada vez más cerca de encontrar un enfoque novedoso para el tratamiento, gracias a su investigación innovadora sobre la molécula de señalización del receptor quinasa 5 acoplado a proteína G (GRK5). Los investigadores de Temple muestran en un nuevo trabajo que GRK5, que ya se sabe que influye en la hipertrofia cardíaca, promueve la remodelación cardíaca desadaptativa y la disminución progresiva de la función cardíaca al mantener vivas las células cardíacas. En modelos celulares y animales, se descubrió que GRK5 induce específicamente p53, una proteína que normalmente induce la apoptosis, una forma de muerte celular, y regula la actividad de los fibroblastos, que contribuyen al crecimiento anormal del corazón y la pérdida funcional.
El estudio, publicado en línea en el Revista del Colegio Americano de Cardiología: ciencia básica a traslacional, es el primero en relacionar la hipertrofia cardíaca y GRK5 con p53, que es más conocida por su implicación en el cáncer. El nuevo trabajo también demuestra la capacidad de GRK5 para operar en el núcleo de la célula cardíaca a través de una vía denominada no canónica o alternativa.
«En este nuevo estudio, analizamos los mecanismos de acción de GRK5, revelando la importancia de su actividad catalítica para influir en la función miocárdica a través de la regulación directa de cardiomiocitos y fibroblastos», dijo Walter J. Koch, Ph.D., WW Smith Endowed Catedrático de Medicina Cardiovascular, Profesor y Presidente del Departamento de Ciencias Cardiovasculares y Director del Centro de Medicina Traslacional de la Facultad de Medicina de Katz, así como autor correspondiente del nuevo estudio.
«GRK5 es una proteína multifuncional expresada en varios tipos de células, incluidos los cardiomiocitos y las células cancerosas», explicó Alessandro Cannavo, Ph.D., profesor asociado en el Departamento de Ciencias Médicas Traslacionales de la Universidad Federico II de Nápoles y autor principal del estudio. «Además, GRK5 puede ser una proteína protectora o una proteína tóxica, dependiendo de si está dentro o fuera del núcleo celular».
El Dr. Cannavo, quien comenzó este estudio mientras era becario en el laboratorio del Dr. Koch en la Facultad de Medicina de Katz antes de que ocupara su puesto en la facultad de Naples, y sus colegas llevaron a cabo su investigación en células que expresaban una forma de GRK5 incapaz de ingresar al núcleo y en ratones que expresaron una versión mutada catalíticamente inactiva de la molécula conocida como GRK5-K215R. Los experimentos in vitro mostraron que cuando se evitaba que GRK5 entrara en el núcleo, los niveles de p53 aumentaban y se potenciaba la muerte celular. En el modelo de ratón, la expresión de GRK5 catalíticamente inactivo se asoció con marcadas disminuciones en la función cardíaca. Además, en los fibroblastos, la mutación K215R promovió la transición a un fenotipo de miofibroblastos, lo que está relacionado con una remodelación desadaptativa y una función disminuida del corazón.
«Nuestros datos indican que la influencia de GRK5 en la hipertrofia cardíaca se debe no solo a su actividad catalítica sino también a su actividad en el núcleo de las células cardíacas», dijo el Dr. Koch. «Esto sugiere que terapéuticamente, en lugar de inhibir GRK5 globalmente, dentro y fuera del núcleo, los procesos de mala adaptación se bloquearían de manera más efectiva mediante el uso de medicamentos que impidan específicamente que GRK5 ingrese al núcleo».
Siguiendo los nuevos hallazgos, los investigadores planean explorar más a fondo el papel de p53 en la insuficiencia cardíaca e investigar los efectos de GRK5 catalíticamente inactivo después de un ataque cardíaco. «Estamos interesados en comprender cómo la pérdida de actividad catalítica de GRK5 afecta la remodelación cardíaca y la función cardíaca después de un ataque cardíaco, lo que genera una enorme tensión en el corazón», agregó el Dr. Koch.
Detener la actividad reguladora de genes de la molécula de señalización podría ayudar a prevenir la insuficiencia cardíaca
Federica Marzano et al, La inactivación catalítica genética de GRK5 afecta la función cardíaca en ratones a través de niveles desregulados de P53, JACC: Ciencia Básica a Traslacional (2022). DOI: 10.1016/j.jacbts.2022.01.001
Citación: El equipo aclara la vía molecular que impulsa los procesos de mala adaptación en la insuficiencia cardíaca, dando paso a nuevas terapias (15 de marzo de 2022) consultado el 16 de marzo de 2022 en https://medicalxpress.com/news/2022-03-team-elucidates-molecular-pathway- inadaptado.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.