Gráficamente abstracto. Crédito: Daniel Hirschhorn et al, Las inmunoterapias de células T involucran a los neutrófilos para eliminar las variantes de escape del antígeno tumoral, Celúla (2023). DOI: 10.1016/j.cell.2023.03.007
Dos estudios independientes de Ludwig Cancer Research publicados en la edición actual de la revista Celúla muestran que las células inmunitarias conocidas como neutrófilos, cuya abundancia en el microambiente de los tumores se ha asociado tradicionalmente con un mal pronóstico del paciente, pueden desempeñar un papel importante en el éxito de las inmunoterapias contra el cáncer.
Uno estudiarcodirigido por Mikaël Pittet, miembro de Ludwig Lausanne, y Allon Klein de la Escuela de Medicina de Harvard, identifica un estado funcional asumido por los neutrófilos después de la inmunoterapia, denominado SellHola estado, en el que se convierten en formidables agentes de inmunidad antitumoral en modelos de cáncer de pulmón y colon en ratones.
«Nuestros resultados demuestran que los neutrófilos, que desempeñan un papel importante en la lucha contra los patógenos microbianos, también pueden movilizarse para combatir el cáncer si se involucran adecuadamente», dijo Pittet.
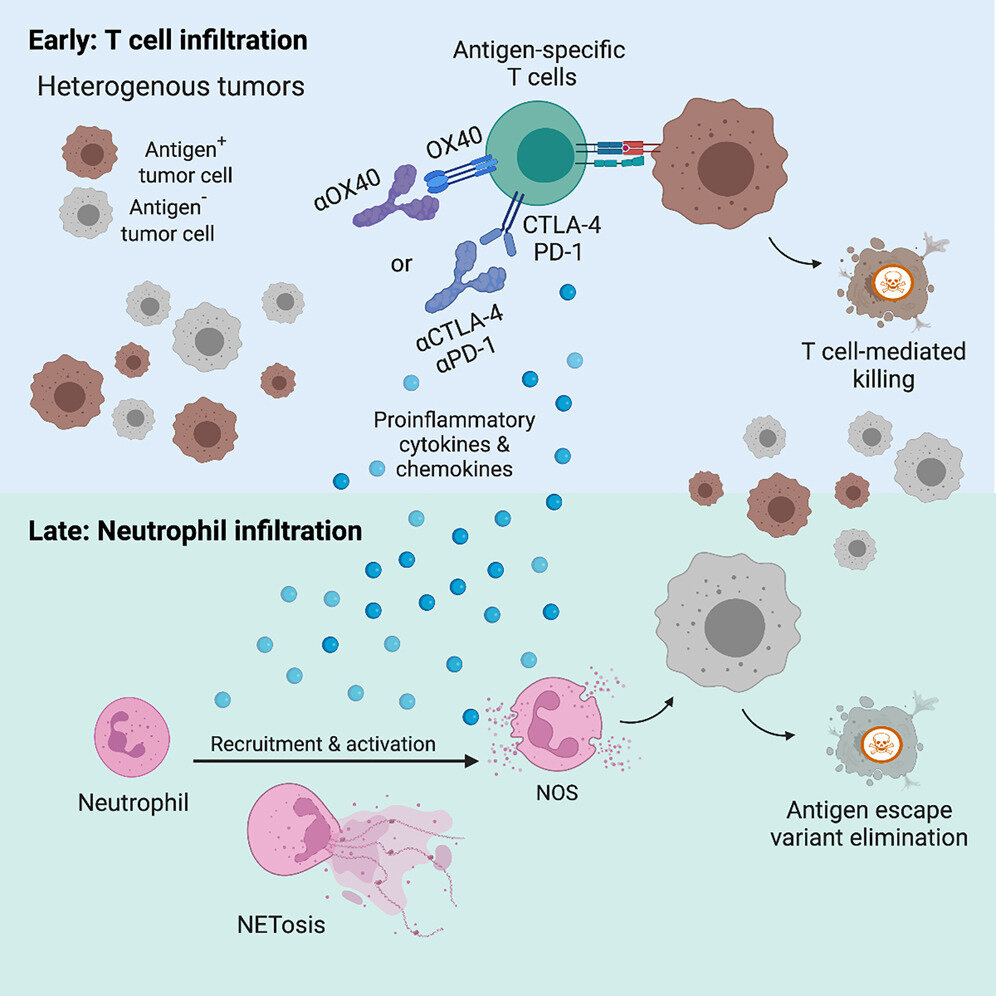
el otro ludwig estudiar, dirigido por Taha Merghoub y Jedd Wolchok, codirectores del Ludwig Collaborative Laboratory en Weill Cornell Medicine, descubrió simultáneamente en un modelo de ratón con melanoma que los neutrófilos son esenciales para la destrucción completa de los tumores durante inmunoterapias como el bloqueo del punto de control inmunitario (ICB) . Como reflejo de estos hallazgos, se encontró que las muestras de tumores de pacientes tratados con éxito con ICB estaban repletas de neutrófilos.
«Nuestro estudio identificó una subpoblación única de neutrófilos con actividad antitumoral», dijo Merghoub. «Cuando se activa mediante una inmunoterapia experimental, esta subpoblación mata las células cancerosas que han evolucionado para escapar de un mecanismo clave de reconocimiento inmunológico y, por lo tanto, ayuda a eliminar los tumores de melanoma avanzados en ratones».
La mayoría de las inmunoterapias que se utilizan en la actualidad, incluida la ICB, activan principalmente las células T CD8+, que reconocen y destruyen las células cancerosas. Múltiples tipos de células inmunitarias muestran un grado de plasticidad, que puede cambiarlas de estados que favorecen el crecimiento tumoral a aquellos que eliminan los tumores. Un creciente cuerpo de evidencia de estudios con ratones sugiere que los neutrófilos también muestran tal dicotomía funcional. Sin embargo, durante mucho tiempo se ha descuidado la investigación matizada de su comportamiento en tumores y durante la inmunoterapia, en parte debido a las limitaciones de las técnicas que utilizan los investigadores para aislar y analizar células individuales en tales estudios.
Pittet, Klein y sus colegas, que han estado explorando las diferencias funcionales sutiles dentro de las poblaciones de neutrófilos, encontraron que tanto en los ratones como en los cánceres de pulmón humanos, el número de neutrófilos aumenta en los tumores que responden a la inmunoterapia. Muestran en modelos de cáncer de pulmón y colon que, en tumores sensibles, son los neutrófilos en el SellHola afirman que explotan en número y que su expansión es fundamental para el éxito de la inmunoterapia.
«Descubrimos que si bloqueamos esta respuesta de neutrófilos provocada por la terapia en ratones, se pierden los beneficios de la inmunoterapia», dijo Pittet.
Los investigadores muestran en este estudio que los neutrófilos empujaron a SellHola durante la inmunoterapia efectiva tienen este patrón de expresión génica. Su disección de la activación de neutrófilos en un modelo de ratón de cáncer de colon revela que se basa en tres pilares clave de la inmunidad antitumoral. Depende, específicamente, de la producción por parte de las células inmunitarias relacionadas de un factor (IL12) que activa las células T asesinas, que a su vez producen una proteína de señalización llamada interferón-ɣ, que estimula aún más las respuestas inmunitarias y, lo que es más importante, permite que SellHola respuesta de neutrófilos.
Merghoub, Wolchok y su equipo estaban estudiando un aspecto diferente de la inmunología tumoral cuando descubrieron los neutrófilos.
A medida que los tumores avanzan, las células cancerosas que los constituyen a menudo evolucionan para dejar de producir antígenos (fragmentos de proteínas que traicionan la enfermedad a las células T y otras células inmunitarias) para escapar de los objetivos inmunitarios. Los investigadores habían demostrado previamente que una inmunoterapia combinada que habían estado desarrollando podría eliminar los tumores de melanoma avanzados en un modelo de ratón, aparentemente superando tal evasión inmunológica.
Esa combinación implica una quimioterapia y un par de inmunoterapias experimentales: una infusión de células T CD4+ diseñadas para atacar un antígeno de melanoma y un tratamiento con anticuerpos que activan una molécula en las células T conocida como OX40. Esta última terapia cambia las células T CD4+, más conocidas por orquestar las respuestas inmunitarias, a un modo de eliminación de células cancerosas mientras inactiva las células T reguladoras que suprimen las respuestas inmunitarias.
En el estudio actual, Merghoub, Wolchok y sus colegas exploraron los mecanismos por los cuales su terapia experimental elimina las células cancerosas que han evolucionado para escapar del reconocimiento de las células T utilizando un modelo de ratón diseñado para el estudio de la heterogeneidad antigénica.
Su análisis reveló que los tumores en los ratones se infiltraron constantemente con neutrófilos activados después de la inmunoterapia, algo que también observaron en muestras de tumores de pacientes con melanoma que habían respondido bien a la terapia con ICB. El agotamiento de los neutrófilos en los ratones comprometió la eficacia curativa de la terapia experimental. También muestran que estos neutrófilos contribuyen a la eliminación del tumor en un modelo de cáncer colorrectal.
«Nuestros hallazgos revelan un papel esencial y previamente no reconocido que desempeñan los neutrófilos en la limpieza de las células cancerosas que evaden el ataque de las células T estimuladas por las inmunoterapias», dijo Wolchok. «Reiteran la importancia de otros tipos de células inmunitarias en el éxito de la ICB y otras inmunoterapias que activan las respuestas de las células T para tratar el cáncer».
Haciéndose eco de los hallazgos del estudio de Ludwig Lausanne, el estudio de Medicina de Ludwig Weill Cornell identificó firmas de expresión génica únicas y marcadores moleculares de superficie celular en neutrófilos dirigidos a tumores. Además, los neutrófilos activados que ayudaron a eliminar las variantes de células cancerosas que habían eludido el reconocimiento de las células T expresaron altos niveles de una enzima que impulsa la producción de óxido nítrico y está asociada con una mayor capacidad de destrucción de células en los neutrófilos.
«Nuestros estudios han llegado de forma independiente a la misma conclusión sobre la importancia de la actividad de los neutrófilos para el éxito de distintas inmunoterapias en modelos de tres tipos diferentes de tumores», señaló Pittet. «Esto sugiere que hemos descubierto una dimensión importante de la inmunología tumoral que, esperamos, allanará el camino para nuevas estrategias de tratamiento y la mejora de las inmunoterapias existentes contra el cáncer».
Más información:
Jeremy Gungabeesoon et al, Una respuesta de neutrófilos vinculada al control de tumores en inmunoterapia, Celúla (2023). DOI: 10.1016/j.cell.2023.02.032
Daniel Hirschhorn et al, Las inmunoterapias de células T involucran a los neutrófilos para eliminar las variantes de escape del antígeno tumoral, Celúla (2023). DOI: 10.1016/j.cell.2023.03.007
Citación: Dos estudios de investigación sobre el cáncer revelan el papel esencial de los neutrófilos en la inmunoterapia (1 de abril de 2023) consultado el 1 de abril de 2023 en https://medicalxpress.com/news/2023-03-cancer-reveal-essential-role-neutrophils.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.