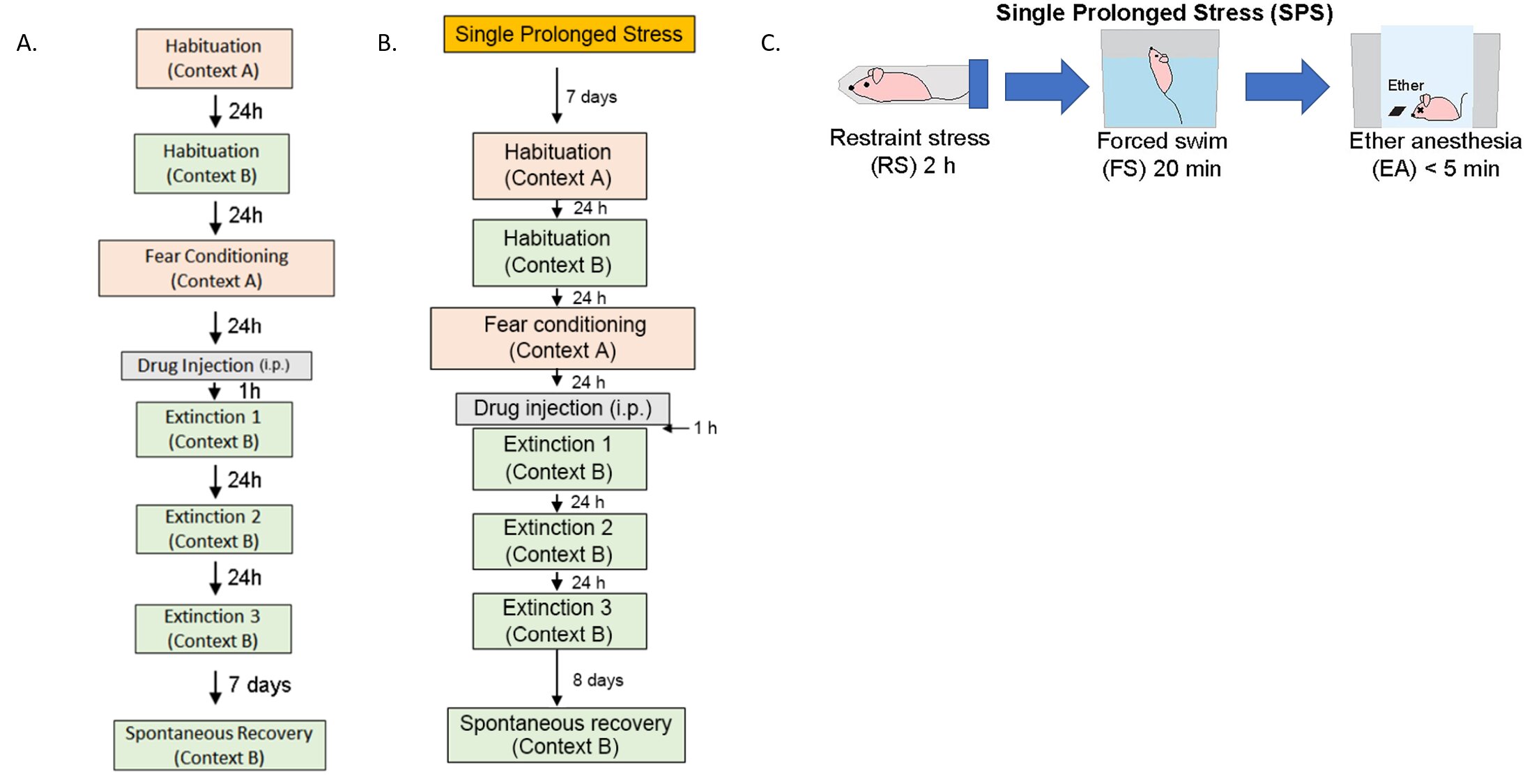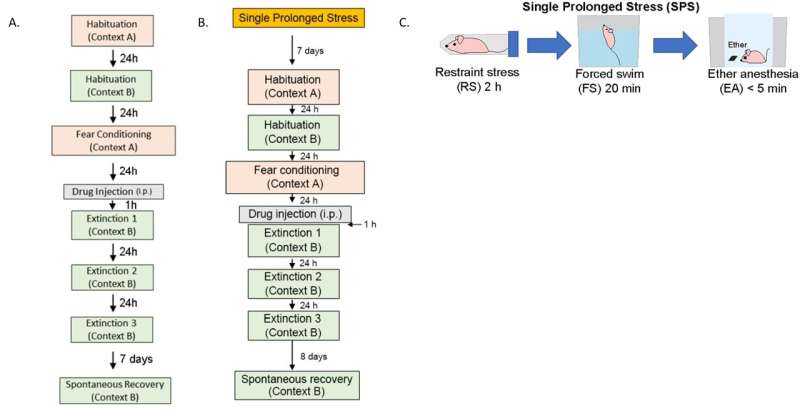
Configuración experimental utilizando un modelo de ratón de PTSD. A) modelo de condicionamiento de miedo auditivo, B) modelo de estrés prolongado único y C) esquema de estrés prolongado único infligido a los animales. Crédito: Instituto de Ciencias Básicas
El trastorno de estrés postraumático (PTSD, por sus siglas en inglés) es una condición de salud mental difícil de curar que es causada por experimentar un evento traumático, como violencia interpersonal o desastre. Si bien las personas que padecen PTSD han existido a lo largo de toda la historia humana y la condición se observa incluso en animales, el diagnóstico de esta condición solo apareció en la década de 1970 después de la Guerra de Vietnam. Los pacientes con PTSD son ampliamente conocidos por sufrir varios síntomas de flashbacks recurrentes, ansiedad y alteración negativa en la cognición.
Actualmente, se utilizan varias opciones de tratamiento, como los antidepresivos o la terapia cognitiva conductual, para tratar el PTSD. Los inhibidores selectivos de la recaptación de serotonina (ISRS) son la única clase de antidepresivos que están aprobados para el tratamiento del TEPT. Sin embargo, los medicamentos tienen inconvenientes de acción retardada y no son efectivos en algunos pacientes.
Las terapias cognitivo-conductuales, como la desensibilización y el reprocesamiento por movimientos oculares (EMDR), también se utilizan con frecuencia para tratar el TEPT. Sin embargo, tales terapias de extinción del miedo no son efectivas en la mitad de los pacientes. Además, incluso cuando la terapia es exitosa, el PTSD es notorio por la recurrencia de los síntomas. Tal recaída de PTSD previamente tratado se llama «recuperación espontánea», que es un tema de muchos estudios.
En el pasado, los estudios han señalado que las actividades en las neuronas glutamatérgicas son una parte importante de la fisiopatología del TEPT. Hay un interés particular en los efectos del receptor de N-metil-D-aspartato (NMDAR) en estas neuronas, que es responsable de controlar la plasticidad sináptica relacionada con el aprendizaje y la memoria.
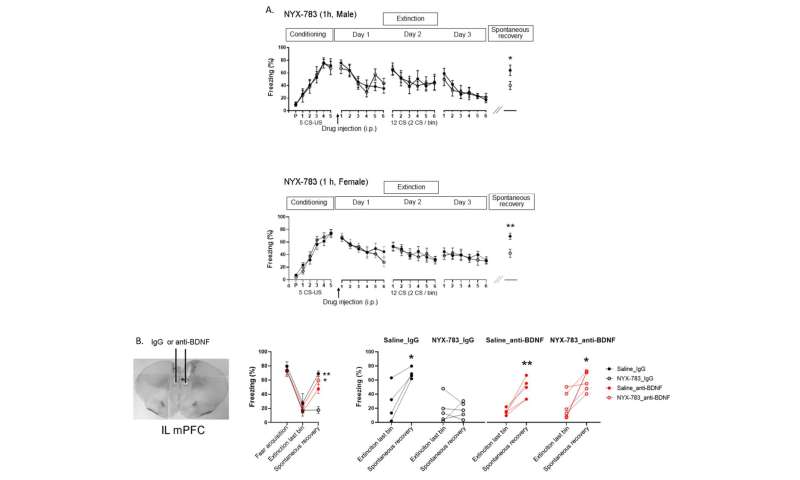
Datos experimentales de este estudio. A) La inyección de NYX-783 antes de la terapia de extinción resultó en la extinción exitosa de los recuerdos del PTSD y evitó la recuperación espontánea. El tratamiento farmacológico fue más efectivo en ratones hembra, lo que sugiere una sensibilidad diferencial de los moduladores NMDAR en machos y hembras. B) Cuando se bloqueó la actividad del BDNF endógeno en el cerebro del ratón usando un anticuerpo, la memoria del PTSD se recuperó espontáneamente incluso después de una extinción exitosa. Cuando se bloqueó la actividad del BDNF endógeno, a los ratones inyectados con NYX-783 no les fue mejor que a los inyectados con solución salina. Crédito: Instituto de Ciencias Básicas
Para abordar el TEPT de raíz, los investigadores del Centro de Cognición y Socialidad del Instituto de Ciencias Básicas (IBS), junto con la Universidad de Yale, exploraron el mecanismo molecular del tratamiento del TEPT. En su última investigación, publicada en Psiquiatría Molecular, el equipo de IBS probó un fármaco de prueba para el TEPT llamado NYX-783 en ratones y examinó el mecanismo molecular de sus acciones. NYX-783 es un fármaco recientemente descubierto que se sabe que modula las funciones de NMDAR en las neuronas.
Hay dos modelos establecidos de TEPT en roedores: condicionamiento auditivo del miedo (AFC) y modelos de estrés prolongado único (SPS). Para el condicionamiento auditivo del miedo, los ratones se habituaron a un entorno y se sometieron a una combinación de un tono y una descarga eléctrica para que el condicionamiento del miedo indujese el TEPT. Para inducir un estrés prolongado único, algunos de los ratones fueron expuestos a múltiples factores estresantes para inducir un estrés prolongado único antes del condicionamiento del miedo. Cabe señalar que es bien sabido que la experiencia estresante antes del condicionamiento del miedo causa más dificultades en el tratamiento del PTSD más adelante.
Luego, los ratones se colocaron en un nuevo entorno y se sometieron a una serie de procedimientos de extinción de la memoria en un intento de eliminar sus recuerdos traumáticos. Para aumentar la terapia cognitiva conductual, los investigadores probaron el rendimiento de NYX-783 junto con la ketamina, que es un conocido medicamento antidepresivo de acción rápida. Se descubrió que inyectar el fármaco a los ratones una hora antes de la terapia de extinción del miedo dio como resultado la mayor tasa de éxito del tratamiento.
Después del tratamiento, se monitoreó el comportamiento de congelación de los ratones al escuchar el mismo sonido para medir el nivel de miedo que estaban experimentando. Se confirmó que a los ratones inyectados con NYX-783 les fue mucho mejor que a los inyectados con ketamina o controles de solución salina. El fármaco fue particularmente eficaz para suprimir la recuperación espontánea o el regreso no deseado del PTSD. El fármaco se comportó de manera diferente según el sexo de los ratones, y las hembras respondieron de forma más positiva al tratamiento que los machos.
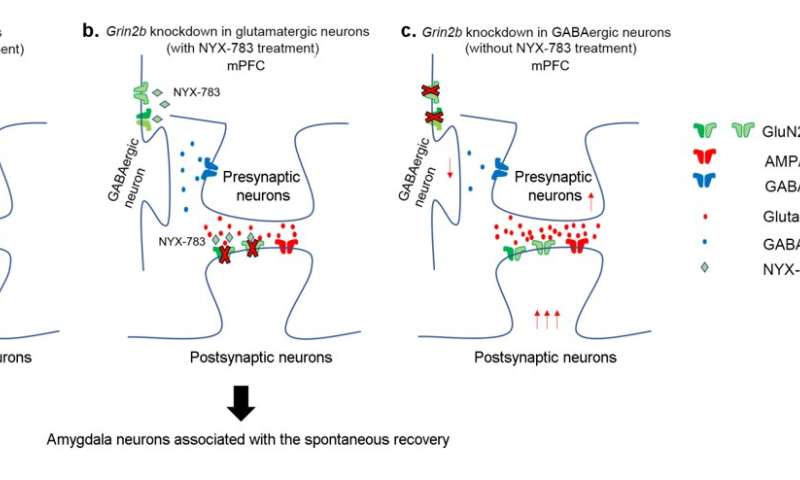
Mecanismo molecular putativo del tratamiento del PTSD. A) En ratones normales, NYX-783 actúa sobre la subunidad GluN2B de los receptores NMDA en las neuronas glutamatérgicas, lo que da como resultado una regulación al alza de BDNF e inhibición de la recuperación espontánea del PTSD. B) Cuando se derriba GluN2B en las neuronas glutamatérgicas, se elimina la eficacia de NYX-783, ya que el fármaco ya no tiene un objetivo válido. C) Cuando se derriba GluN2B en las neuronas GABAérgicas, disminuye el grado de inhibición de la neurona glutamatérgica. Se libera más glutamato, que activa la neurona piramidal postsináptica, lo que da como resultado una reducción inicial en la recuperación espontánea. Crédito: Instituto de Ciencias Básicas
Para explorar el mecanismo del tratamiento, estos experimentos se repitieron junto con la manipulación genética. Primero, se descubrió que NYX-783 inhibe los recuerdos del miedo y suprime la recuperación espontánea de esos recuerdos al modular los receptores NMDA, específicamente al actuar sobre la subunidad GluN2B. Para probar esto, los investigadores derribaron la subunidad GluN2B de NMDAR manipulando el gen Grin2b usando vectores virales. Como era de esperar, la eficacia del fármaco disminuyó en su mayoría cuando los receptores fueron eliminados en las neuronas glutamatérgicas en la corteza prefrontal medial. En particular, el mutante knockdown de Grin2b exhibió una recuperación espontánea, incluso si se le inyectó NYX-783.
Por otro lado, el rendimiento del fármaco no se vio afectado cuando los mismos receptores fueron derribados en las interneuronas GABAérgicas. Curiosamente, se descubrió que la eliminación de los receptores NMDA en las interneuronas por sí sola era capaz de reducir la recuperación espontánea. El grupo creía que esto era más probable a través de la reducción de los efectos inhibitorios de la interneurona sobre la neurona principal.
Sin embargo, esto no excluye por completo la posibilidad de que NYX-783 actúe sobre las interneuronas inhibidoras. Los autores señalaron: «La caída de Grin2b en interneuronas sin NYX-783 ya muestra un congelamiento bajo durante la recuperación espontánea. Debido a este efecto de piso, es posible que no veamos una reducción adicional en el congelamiento con NYX-783 durante la recuperación espontánea incluso si NYX-783 actúa a través de GluN2B en las neuronas glutamatérgicas». Si bien se cree que la actividad del fármaco en la neurona glutamatérgica es más importante para la producción conductual, es posible que se necesite más investigación para confirmarlo.
Por último, el equipo descubrió que el factor neurotrófico derivado del cerebro (BDNF), que es muy importante para la plasticidad sináptica, es necesario para la extinción de la memoria. Cuando los autores suprimieron la actividad de BDNF en cerebros de ratones mediante un tratamiento con anticuerpos, atenuaron la mayor parte del efecto de NYX-783 sobre la inhibición de la recuperación espontánea.
El autor correspondiente Lee Boyoung del Center for Cognition and Sociality comentó: «Juntos, estos hallazgos sugieren que NYX-783, un nuevo modulador positivo de NMDAR, puede ser un medicamento eficaz para el TEPT. Aunque los estudios clínicos de este compuesto están en curso, estos hallazgos sugieren que el desarrollo de moduladores NMDAR puede ser una estrategia viable para tratar el PTSD».
Posibles avances en el tratamiento del TEPT y las enfermedades cardiovasculares relacionadas con el TEPT
La modulación positiva de los receptores de N-metil-D-aspartato en el mPFC reduce la recuperación espontánea del miedo, Psiquiatría Molecular (2022).
Citación: Desbloqueo del mecanismo molecular del tratamiento del TEPT (13 de abril de 2022) recuperado el 13 de abril de 2022 de https://medicalxpress.com/news/2022-04-molecular-mechanism-ptsd-treatment.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.