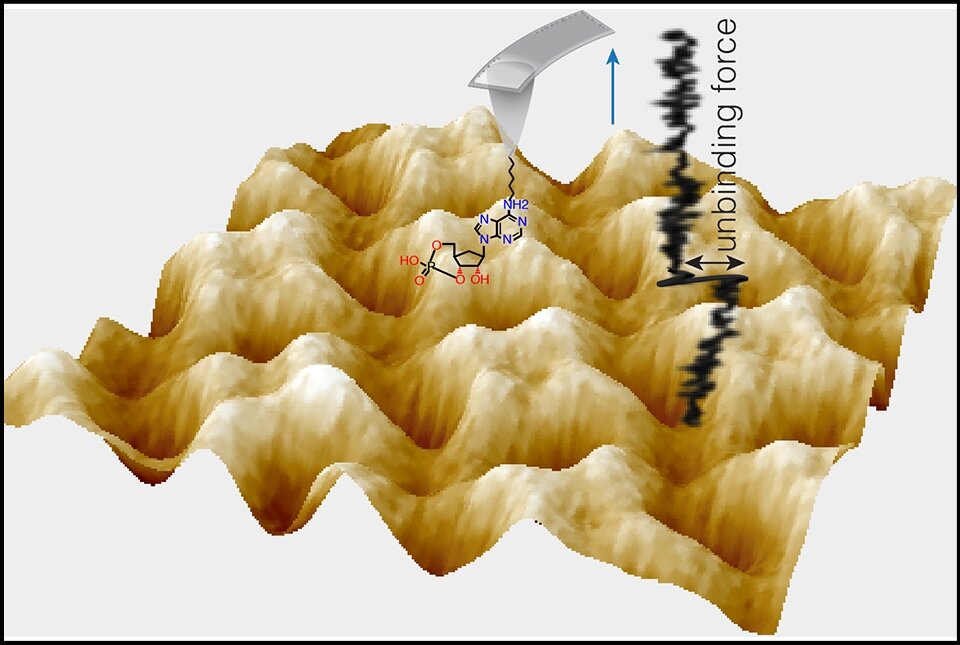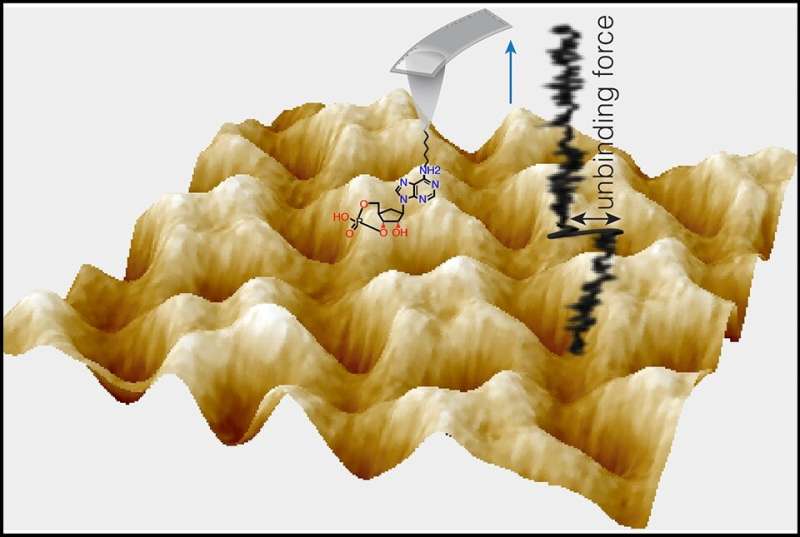
La espectroscopia de fuerza con microscopía de fuerza atómica mide la fuerza de una sola molécula de cAMP o cGMP que se une al bolsillo de unión de nucleótidos cíclicos del canal iónico. Crédito: S Scheuring; CM Nimigean y Y Pan
Según un nuevo estudio dirigido por investigadores de Weill Cornell Medicine, dos moléculas muy similares con roles de señalización esenciales pero a menudo contrastantes en la mayoría de las formas de vida ejercen sus efectos distintos a través de diferencias sutiles en sus enlaces con sus socios de señalización.
En el estudio, publicado el 27 de marzo en Naturaleza Biología Estructural y Molecularlos investigadores utilizaron técnicas de medición exquisitamente sensibles para revelar a nivel de molécula única cómo las moléculas de señalización cAMP y cGMP se unen a un canal iónico de la familia de canales de marcapasos, uno de los principales tipos de proteínas cuyas actividades regulan.
Los canales iónicos son características comunes de las membranas celulares y controlan las funciones celulares básicas al permitir que el calcio, el sodio, el potasio y otros elementos cargados llamados iones entren y salgan de las células. Muchos canales iónicos pueden unirse tanto a cAMP como a cGMP mientras que solo uno de ellos los abre de manera efectiva. Precisamente cómo las dos moléculas ejercen sus diferentes efectos sobre la actividad del canal iónico había sido un misterio.
El estudio detalla cómo cAMP/cGMP se unen a los canales iónicos y avanza en la comprensión de un aspecto fundamental de la biología celular. Estos hallazgos podrían eventualmente inspirar nuevos tratamientos para los trastornos que involucran el mal funcionamiento de los canales iónicos.
«Encontramos diferencias claras en la interacción y la fuerza de unión de estas dos moléculas a los canales iónicos, lo que creemos que explica por qué uno puede abrir el canal y el otro no», dijo el autor principal del estudio, el Dr. Simon Scheuring, profesor de fisiología y biofísica en anestesiología en Weill Cornell Medicine.
El monofosfato de adenosina cíclico (cAMP) y el monofosfato de guanosina cíclica (cGMP) se conocen como nucleótidos cíclicos: «cíclicos» porque sus estructuras químicas contienen motivos cíclicos o anulares, y «nucleótidos» porque forman parte de la misma familia de moléculas que la construcción de nucleótidos. bloques A y G de ADN. Parecen haber evolucionado como interruptores multipropósito capaces de regular la actividad de una amplia gama de objetivos proteicos diferentes.
A menudo, solo uno de ellos, cAMP o cGMP, es el activador, mientras que el otro hace poco o nada directamente sobre el objetivo, pero puede forzarlo a un estado inactivo al unirse al mismo sitio, por lo que la competencia entre las dos moléculas cambia los canales. encendido y apagado.
Las proteínas reguladas por cAMP/cGMP incluyen una gran clase de canales iónicos denominados canales iónicos controlados por nucleótidos cíclicos (CNG). Los canales CNG tienen funciones importantes en todo el sistema nervioso, incluso en las neuronas sensoriales que median el olfato y la visión, y en las células marcapasos que gobiernan el ritmo de los latidos del corazón.
El Dr. Scheuring, que ayudó a ser pionero en el uso de una técnica de medición sensible llamada microscopía de fuerza atómica (AFM), y la Dra. Crina Nimigean, experta en canales de iones y profesora de fisiología y biofísica en anestesiología en Weill Cornell Medicine, ya han realizado un progreso considerable en la comprensión de cómo cAMP/cGMP regulan los canales CNG. en un 2018 papelpor ejemplo, utilizaron AFM de alta velocidad para mostrar cómo un canal de CNG bacteriano, SthK, cambia de conformación cuando se une al cAMP que abre el canal o al cGMP que cierra el canal.
En el nuevo estudio se unieron nuevamente y también se les unió un experto en modelado de dinámica molecular, el Dr. Helmut Grubmüller del Instituto Max Planck de Ciencias Multidisciplinarias en Alemania. Su técnica principal esta vez fue un método de detección de fuerza relacionado con AFM llamado espectroscopia de fuerza de molécula única AFM, que es lo suficientemente sensible como para medir la fuerza de unión de una sola molécula de AMPc o GMPc a su sitio de unión en el canal iónico. Con eso, y la ayuda del modelado computacional, cuantificaron cómo cAMP y cGMP difieren en sus fuerzas y profundidad de unión al mismo sitio de unión en SthK, a través de interacciones con diferentes grupos de átomos dentro del sitio de unión.
«El AMP cíclico puede acceder a un estado de unión más fuerte; es decir, permanece más tiempo en su sitio de unión en el canal de iones, en comparación con cGMP, lo que sugiere que este estado de unión profunda es la clave para la activación del canal», dijo el primer autor del estudio, el Dr. Yangang Pan, investigador postdoctoral en el laboratorio de Scheuring.
El canal SthK es solo un modelo para los canales de GNC de mamíferos, y los investigadores planean estudios futuros con canales de GNC de mamíferos. Pero creen que sus hallazgos de SthK ya iluminan el mecanismo fundamental de cómo cAMP y cGMP funcionan como reguladores en sus muchas funciones a lo largo de la biología.
«Los sitios de unión para cAMP/cGMP se encuentran no solo en los canales iónicos, sino también en las enzimas de señalización, los factores de transcripción y otras proteínas», dijo el Dr. Nimigean. «Sospechamos que en todos los casos, la naturaleza ha sintonizado cómo estas proteínas reconocen cAMP/cGMP, de acuerdo con las funciones de estas proteínas».
Más información:
Yangang Pan et al, Discriminación entre nucleótidos cíclicos en un canal iónico controlado por nucleótidos cíclicos, Naturaleza Biología Estructural y Molecular (2023). DOI: 10.1038/s41594-023-00955-3
Citación: Cómo los mensajeros antiguos cAMP y cGMP entregan sus mensajes (9 de mayo de 2023) recuperado el 9 de mayo de 2023 de https://phys.org/news/2023-05-ancient-messengers-cgmp-messages.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.