Crédito: Universidad Tecnológica de Eindhoven
¿Por qué algunas personas experimentan pocos síntomas, mientras que otras se enferman gravemente cuando se infectan con un virus como la gripe o el COVID-19? Doctor. La investigadora Laura Van Eyndhoven trató de responder a esta pregunta observando las células una célula a la vez. Su investigación proporciona información valiosa sobre cómo las células inmunitarias individuales influyen en la inmunidad sistémica, lo que podría conducir a terapias personalizadas para el cáncer y las enfermedades autoinmunes en el futuro.
Algo que desconcierta a muchos es la gama de síntomas que muestran diferentes personas cuando se infectan por un virus como el COVID-19. Algunos se enferman gravemente, mientras que otros muestran pocos o ningún síntoma, a pesar de que dan positivo por el virus.
¿Cuál es la causa de tales variaciones en términos de síntomas? ¿Y qué papel juega el comportamiento y la comunicación unicelulares? Doctor. La investigadora Laura Van Eyndhoven se dispuso a abordar estas preguntas y más al observar cómo se comportan las células individuales cuando se infectan con un virus.
El efecto dominó
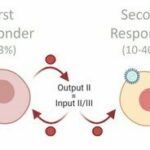
«Cuando un virus invade, solo una pequeña fracción de las células infectadas, los llamados socorristas, informan a otras células a su alrededor que están infectadas. En otras palabras, los socorristas desempeñan un papel especial para que el cuerpo sepa cuándo está bajo ataque», dice Van Eyndhoven, quien completó su Ph.D. investigación en el grupo de Inmunoingeniería bajo la supervisión de Jurjen Tel y Carlijn Bouten.
Para informar a las células no infectadas y a las células inmunitarias más importantes que el cuerpo está bajo ataque, los primeros en responder producen proteínas de señalización conocidas como interferones tipo I (IFN-I para abreviar). «La producción de IFN-Is es un paso crucial cuando se trata de eliminar una infección viral», señala van Eyndhoven. «Esto se debe a que las células que primero producen IFN-I inician la producción de IFN-I en otras células, incluidas las células inmunitarias. Es como un efecto dominó».
Evita la tormenta de citoquinas
La comunicación mediante interferones es fundamental, pero también es importante la comunicación entre las células inmunitarias sobre la producción de la cantidad adecuada de interferones. «Si se produce demasiado IFN-I, aumentan las posibilidades de que alguien desarrolle una enfermedad autoinmune, pero si se produce muy poco, podría conducir a una eliminación fallida de los virus», dice Van Eyndhoven.
Entonces, ¿cómo funcionan las cosas con una infección viral como COVID-19? explica Van Eyndhoven. «Una vez infectadas con COVID-19, es crucial que las células comiencen a producir IFN-I rápidamente, ya que esto acelera el proceso de eliminación de la infección. Si este proceso se retrasa y las células tardan demasiado en comenzar a producir IFN- Es decir, el virus puede replicarse libremente, lo que lleva a una alta carga viral y a un catastrófico exceso de producción de IFN-Is. Esto conduce a las llamadas tormentas de citoquinas (inflamación descontrolada que resulta en condiciones graves que amenazan la vida) e inflamación crónica».
Una celda a la vez
Se supone que los diferentes síntomas que muestran las personas cuando se infectan con virus, como la gripe o el COVID-19, se atribuyen a las diferentes tasas de producción inicial de interferón por parte de una pequeña fracción de células entre las personas. «Podría darse el caso de que aquellos que desarrollan síntomas graves tras la infección tengan células de primera respuesta ‘perezosas'», comenta Van Eyndhoven. Entonces, ¿cómo se puede estudiar esto en detalle?
«Gracias a los avances recientes, ahora tenemos la tecnología para estudiar los comportamientos de células inmunitarias individuales y manipular sus comportamientos. En otras palabras, podemos estudiar las células una célula a la vez», dice van Eyndhoven. «Y para mi investigación recurrí a experimentos con células inmunitarias primarias, aisladas tanto de donantes sanos como de pacientes con enfermedades autoinmunes. A su vez, los modelos informáticos nos permitieron interpretar los resultados de laboratorio».
Para estudiar células inmunitarias individuales en el laboratorio, Van Eyndhoven utilizó dispositivos de microfluidos. «Pude estudiar y activar células inmunitarias individuales en gotas de picolitros, lo que era prácticamente imposible en el pasado. Esto proporcionó información sobre cómo una célula individual se comunica con las células que podrían estar cerca».
Los experimentos de microfluidos podrían haber ayudado a comprender el comportamiento de las células individuales, pero resultó muy difícil para Van Eyndhoven y sus colaboradores estudiar los mismos comportamientos en un entorno in vivo. «Fue entonces cuando recurrimos al modelado por computadora, ya que los modelos pueden aproximarse a un gran sistema celular y, al mismo tiempo, tener en cuenta diferentes cosas, como moléculas que interactúan, tejidos complejos e incluso el paciente».
El destino de las células de primera respuesta
Al combinar la microfluídica con el modelado por computadora, Van Eyndhoven pudo estudiar la producción de interferón en células individuales y comparar los resultados con casos de grandes grupos de células. Ella y sus colegas hicieron un descubrimiento sorprendente sobre el destino de las células de primera respuesta que podría servir como un hallazgo importante cuando se trata de mejorar las terapias dirigidas a IFN-Is.
«Solo entre el 1% y el 3% de las células son células de primera respuesta, las primeras células en producir IFN-I tras la infección. Sin embargo, las células de primera respuesta no comienzan a producir IFN-I al azar tras la infección, como se suponía en el pasado. En cambio, , mi investigación muestra que estas células están destinadas a ser los primeros en responder. Su destino está predeterminado en gran medida».
Visión de futuro
Los conocimientos obtenidos en la investigación de Van Eyndhoven forman el trampolín hacia la comprensión de los fundamentos de cómo las células individuales realizan colectivamente funciones a nivel del sistema y cómo pueden manipularse para tratamientos terapéuticos.
«Imagino un futuro en el que las terapias personalizadas se dirijan a perfiles de secreción de citoquinas aberrantes (donde las células individuales toman decisiones incorrectas), como se observa en numerosas enfermedades autoinmunes», dice Van Eyndhoven.
Más información:
Decodificación de la dinámica de respuesta del interferón tipo I mediante microfluidos y modelado. research.tue.nl/en/publication … usando-microfluidos-
Citación: ¿Cómo hacen correr la voz las células durante una infección viral? (9 de marzo de 2023) recuperado el 9 de marzo de 2023 de https://medicalxpress.com/news/2023-03-cells-word-viral-infection.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.