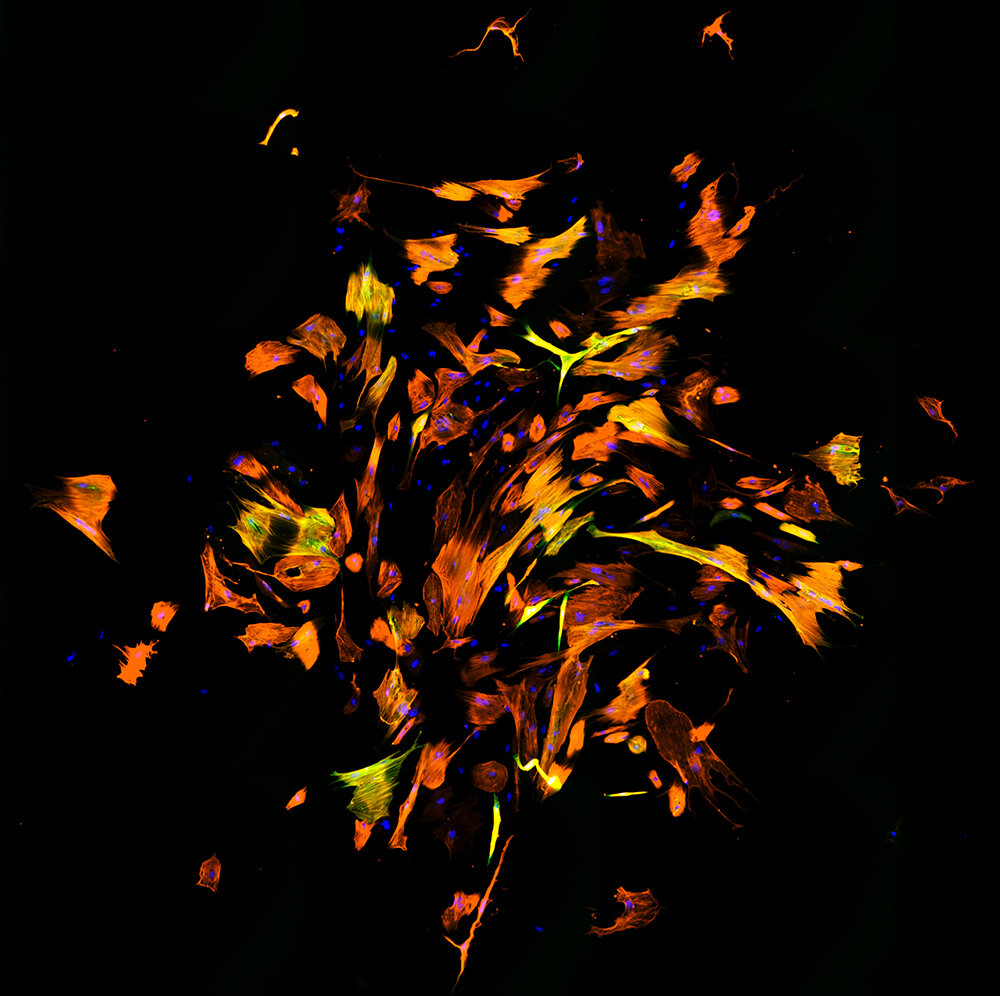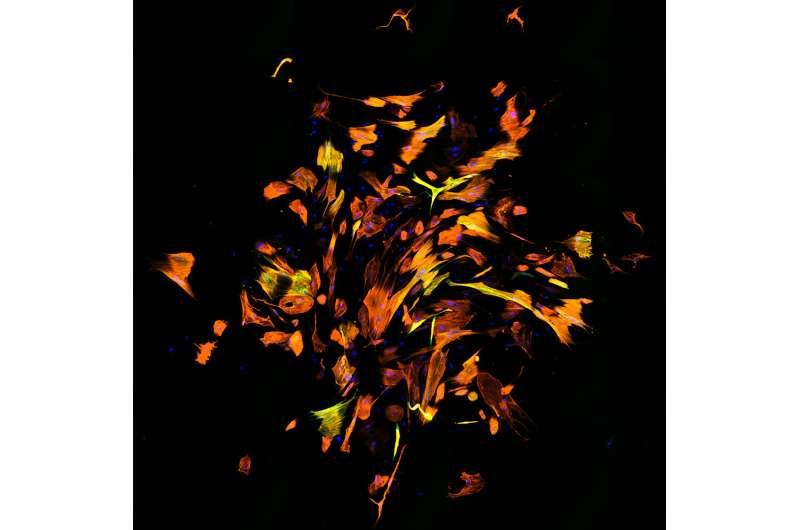
Fibroblastos humanos reprogramados en células similares a cardiomiocitos. La inmunofluorescencia muestra diferentes moléculas: ADN (azul), Troponina T cardíaca (naranja) y αActinina (verde). Crédito: Qian Lab, Facultad de Medicina de la UNC
Científicos de la Facultad de Medicina de la UNC han logrado un avance significativo en el prometedor campo de la reprogramación celular y la regeneración de órganos, y el descubrimiento podría desempeñar un papel importante en futuros medicamentos para curar corazones dañados.
En un estudio publicado en la revista Célula Célula Madre, científicos de la Universidad de Carolina del Norte en Chapel Hill descubrieron un método más simplificado y eficiente para reprogramar las células del tejido cicatricial (fibroblastos) para que se conviertan en células sanas del músculo cardíaco (cardiomiocitos). Los fibroblastos producen el tejido fibroso y rígido que contribuye a la insuficiencia cardíaca después de un ataque cardíaco o debido a una enfermedad cardíaca. Se está investigando la conversión de fibroblastos en cardiomiocitos como una posible estrategia futura para tratar o incluso curar algún día esta afección común y mortal.
Sorprendentemente, la clave de la nueva técnica de producción de cardiomiocitos resultó ser una proteína que controla la actividad de los genes llamada Ascl1, que se sabe que es una proteína crucial involucrada en convertir los fibroblastos en neuronas. Los investigadores habían pensado que Ascl1 era específico de las neuronas.
«Es un hallazgo innovador y esperamos que sea útil para desarrollar futuras terapias cardíacas y potencialmente otros tipos de reprogramación celular terapéutica», dijo el autor principal del estudio, Li Qian, Ph.D., profesor asociado en el Departamento de UNC. de Patología y Medicina de Laboratorio y director asociado del McAllister Heart Institute en la Facultad de Medicina de la UNC.
Durante los últimos 15 años, los científicos han desarrollado varias técnicas para reprogramar células adultas para que se conviertan en células madre y luego inducirlas a convertirse en células adultas de algún otro tipo. Más recientemente, los científicos han estado encontrando formas de hacer esta reprogramación de manera más directa, directamente de un tipo de célula madura a otro. La esperanza ha sido que cuando estos métodos sean lo más seguros, efectivos y eficientes posible, los médicos podrán utilizar una simple inyección en los pacientes para reprogramar las células que causan daños en células beneficiosas.
«La reprogramación de fibroblastos ha sido durante mucho tiempo uno de los objetivos importantes en el campo», dijo Qian. «La hiperactividad de los fibroblastos es la base de muchas enfermedades y afecciones importantes, como la insuficiencia cardíaca, la enfermedad pulmonar obstructiva crónica, la enfermedad hepática, la enfermedad renal y el daño cerebral similar a una cicatriz que se produce después de los accidentes cerebrovasculares».
En el nuevo estudio, el equipo de Qian, incluidos los coautores principales Haofei Wang, Ph.D., investigador postdoctoral y MD/Ph.D. el estudiante Benjamin Keepers, utilizó tres técnicas existentes para reprogramar fibroblastos de ratón en cardiomiocitos, células hepáticas y neuronas. Su objetivo era catalogar y comparar los cambios en los patrones de actividad genética de las células y los factores de regulación de la actividad genética durante estas tres reprogramaciones distintas.
Inesperadamente, los investigadores descubrieron que la reprogramación de fibroblastos en neuronas activaba un conjunto de genes de cardiomiocitos. Pronto determinaron que esta activación se debía a Ascl1, una de las proteínas del «factor de transcripción» del programador maestro que se había utilizado para fabricar las neuronas.
Dado que Ascl1 activó genes de cardiomiocitos, los investigadores lo agregaron al cóctel de tres factores de transcripción que habían estado usando para producir cardiomiocitos, para ver qué pasaba. Se sorprendieron al descubrir que aumentó drásticamente la eficiencia de la reprogramación, la proporción de células reprogramadas con éxito, en más de diez veces. De hecho, descubrieron que ahora podían prescindir de dos de los tres factores de su cóctel original, conservando solo Ascl1 y otro factor de transcripción llamado Mef2c.
En experimentos posteriores, encontraron evidencia de que Ascl1 por sí solo activa los genes de las neuronas y los cardiomiocitos, pero se aleja del papel proneuronal cuando se acompaña de Mef2c. En sinergia con Mef2c, Ascl1 activa un amplio conjunto de genes de cardiomiocitos.
«Ascl1 y Mef2c trabajan juntos para ejercer efectos favorables a los cardiomiocitos que ningún factor ejerce por sí solo, lo que lo convierte en un potente cóctel de reprogramación», dijo Qian.
Los resultados muestran que los principales factores de transcripción utilizados en la reprogramación celular directa no son necesariamente exclusivos de un tipo de célula objetivo.
Quizás lo más importante es que representan otro paso en el camino hacia futuras terapias de reprogramación celular para trastornos importantes. Qian dice que ella y su equipo esperan hacer una proteína sintética dos en uno que contenga las partes efectivas de Ascl1 y Mef2c, y que pueda inyectarse en corazones defectuosos para repararlos.
Los científicos crean un mapa unicelular para reprogramar el tejido cicatricial en células cardíacas sanas
Haofei Wang et al, Potencial de linaje cruzado de Ascl1 descubierto al comparar diversos regulatomas de reprogramación, Célula Célula Madre (2022). DOI: 10.1016/j.tallo.2022.09.006
Citación: Los científicos descubren proteínas asociadas que podrían curar el músculo cardíaco (6 de octubre de 2022) consultado el 6 de octubre de 2022 en https://medicalxpress.com/news/2022-10-scientists-protein-partners-heart-muscle.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.