Crédito: Yoshiko Nakagawa et al, naturaleza química biología (2022). DOI: 10.1038/s41589-021-00951-y
En un hallazgo que tiene ramificaciones importantes para los trastornos neurodegenerativos como la enfermedad de Alzheimer, los investigadores de RIKEN han descubierto cómo tres moléculas chaperonas en las células de levadura trabajan juntas para romper los agregados de proteínas fibrilares ricas en láminas beta conocidas como fibrillas amiloides.
Las proteínas que se pliegan de manera incorrecta no pueden hacer su trabajo correctamente. Algunas proteínas mal plegadas conocidas como priones son particularmente insidiosas porque transmiten sus formas distorsionadas a las proteínas que las rodean, que luego se unen para formar balsas robustas llamadas fibrillas amiloides. Las fibrillas de amiloide se han implicado en enfermedades priónicas (como la enfermedad de Creutzfeldt-Jakob), que siempre son mortales, y en trastornos neurodegenerativos como el Alzheimer y el Parkinson.
El proceso por el cual se forman las fibrillas de amiloide ha recibido mucha atención, pero se sabe mucho menos sobre el mecanismo por el cual se rompen en las células. Este proceso de desagregación es importante porque los fragmentos que produce podrían permitir que los priones se propaguen entre las células.
«Muchos investigadores han investigado el mecanismo de formación de las fibrillas de amiloide, pero ha habido muy pocos estudios sobre la desagregación de amiloide», dice Motomasa Tanaka, del Centro RIKEN para la Ciencia del Cerebro. «Sin embargo, los pequeños fragmentos de proteína sirven como semillas para la formación de fibrillas de amiloide en otros lugares, y nuestro trabajo previo sugiere que la desagregación de amiloide es en realidad más importante que el crecimiento de fibrillas de amiloide».
Además, saber cómo se rompen las fibrillas de amiloide podría ayudar a los investigadores a desarrollar tratamientos para priones y enfermedades neurodegenerativas.
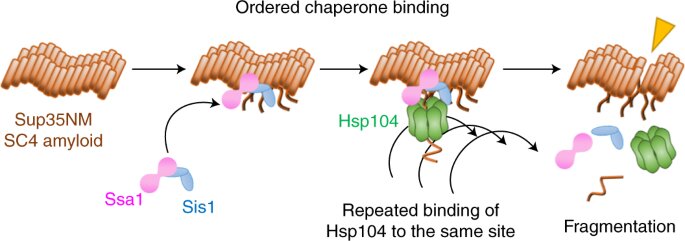
Ahora, Yoshiko Nakagawa, Tanaka y sus colaboradores han utilizado una forma de microscopía de fluorescencia de una sola molécula para filmar cómo se coordinan tres moléculas para romper las fibrillas de amiloide en un sistema de priones en la levadura.
Descubrieron que la ruptura comienza con dos acompañantes, Hsp70 y Hsp40, que preparan el terreno uniéndose a la fibrilla. Una tercera chaperona, Hsp104, luego corta la fibrilla uniéndose repetidamente al mismo sitio.
Curiosamente, el equipo descubrió que, además de este mecanismo de fragmentación, un mecanismo de disolución también rompe las fibrillas, pero mediante una coreografía de chaperonas muy diferente. El mecanismo que se produce depende de la forma molecular, o confirmación, de la fibrilla.
Hubo muchas sorpresas en este estudio, señala Tanaka. «No esperábamos que Hsp104 se uniera al mismo sitio tantas veces para fragmentar las fibrillas de amiloide», dice. «Y los modos de desagregación para las dos confirmaciones de fibrillas diferentes son muy diferentes: el mecanismo de fragmentación produjo muchos fragmentos diminutos, mientras que la fluorescencia de la fibra amiloide desapareció gradualmente por el mecanismo de disolución».
El equipo tiene la intención de explorar los mecanismos con mayor detalle y, en el futuro, esperan lograr una resolución atómica.
Yoshiko Nakagawa et al, Desagregación dependiente de la conformación amiloide en un sistema priónico de levadura reconstituido, naturaleza química biología (2022). DOI: 10.1038/s41589-021-00951-y
Citación: Tres acompañantes coordinan la ruptura de las fibrillas de amiloide en la levadura (26 de mayo de 2022) consultado el 26 de mayo de 2022 en https://phys.org/news/2022-05-chaperones-breakup-amyloid-fibrils-yeast.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.