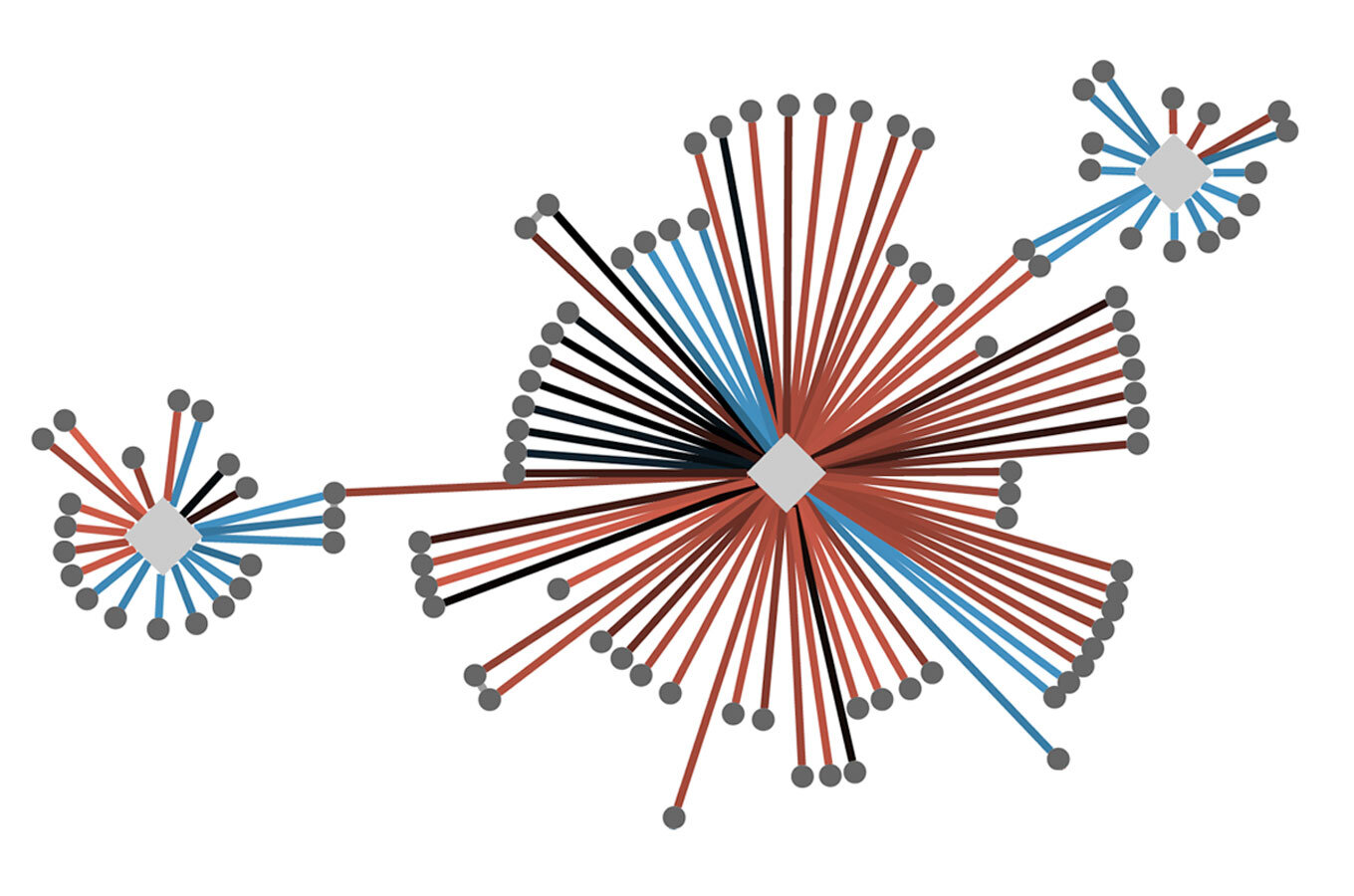
Una versión genérica de un mapa de interacción de proteínas celulares. Las formas de diamante representan proteínas de interés, que se han caracterizado experimentalmente para participar en ciertos «complejos de proteínas» en la célula que se unen para facilitar una función celular particular. Las líneas que emanan hacia el exterior muestran las interacciones físicas entre las proteínas de interés (diamantes) y sus compañeros de interacción (círculos). Estos mapas celulares ayudan a los investigadores a ver cómo se pueden alterar los complejos cuando se mutan las proteínas y a considerar cómo las terapias potenciales podrían afectar la red. Crédito: Laboratorio Krogan
El cáncer de mama, el COVID-19 y el autismo pueden parecer no relacionados, pero comparten algunas conexiones sorprendentes. Algunos de los mismos genes que están mutados en el cáncer de mama también son secuestrados por COVID-19, y algunos otros genes mutados en el cáncer también están implicados en el autismo.
Elementos comunes como estos han llevado a Nevan Krogan, Ph.D., director del Instituto de Biociencias Cuantitativas de la UCSF, a examinar en detalle los efectos de un puñado de genes que parecen desempeñar un papel importante en una amplia gama de enfermedades.
Esos efectos dependen de las proteínas, para las cuales los genes son los planos. Cuando un gen muta, también lo hace su proteína.
«Nuestro genoma es relativamente estático, pero las proteínas no lo son», dijo Krogan. «Están interactuando constantemente con otras proteínas en diferentes contextos que cambian con el tiempo».
Muchas condiciones involucran docenas de mutaciones, agregó. Ver el panorama completo de la enfermedad de una persona significa reconstruir cómo cada una de esas proteínas mutadas contribuye a ella.
Hace más de una década, Krogan comenzó a emplear enfoques cuantitativos sofisticados para crear «mapas celulares» que comparan miles de estas interacciones proteína-proteína, o PPI, en células sanas y enfermas en una variedad de mutaciones en cáncer, autismo y enfermedades infecciosas.
Él cree que concentrarse en estos PPI puede dilucidar cómo las mutaciones interrumpen las funciones celulares y descubrir puntos de entrada para tratamientos más seguros y efectivos.
Las colaboraciones entre Krogan e investigadores en los EE. UU. y en todo el mundo ya han revelado cómo las mutaciones en diferentes genes a veces alteran las mismas vías celulares, iluminando las conexiones entre enfermedades que pueden parecer bastante diferentes a nivel genético.
En otros casos, el mismo gen está implicado en más de una enfermedad: una mutación en el punto A puede contribuir al cáncer, mientras que una mutación en el punto B puede crear una predisposición a un trastorno psiquiátrico.
«Estamos encontrando los talones de Aquiles del genoma», dijo Krogan. «Al ir más allá del ADN y observar estas redes de interacción de proteínas, podemos conectar puntos que antes ni siquiera sabíamos que existían».

Nevan Krogan, Ph.D. Crédito: Noah Berger
Mapeo de la red
Para encontrar esos puntos y dibujar las líneas entre ellos, Krogan, junto con sus colaboradores, usan sus mapas celulares para ver exactamente cómo una mutación específica en un gen en particular se traduce en cambios en las interacciones de las proteínas.
Un gen llamado PIK3CA, por ejemplo, está involucrado en un porcentaje considerable de cánceres, así como en el autismo y otros trastornos cerebrales. Hay cientos de mutaciones conocidas en PIK3CA, cada una de las cuales tiene un efecto específico en la maquinaria de la proteína.
Krogan ha catalogado no solo cómo cada una de estas mutaciones conduce a la enfermedad, sino también cómo se desarrollan las diversas vías de PIK3CA en las células sanas, lo que le permite identificar la intersección donde cada una de estas mutaciones desvía las interacciones de las proteínas de la célula.
Lograr este enfoque granular implica superponer grandes conjuntos de datos y encontrar patrones que señalen el momento molecular en el que un proceso celular falla. Los equipos de Krogan usan espectrometría de masas para pesar las moléculas de proteína y la combinan con otros métodos que evalúan la estructura de la proteína. Se necesitan técnicas computacionales avanzadas para procesar la enorme cantidad de datos involucrados.
Estos mapas pueden ayudar a proporcionar un pronóstico basado en las proteínas resultantes de las mutaciones encontradas en los genes de un paciente en particular; ayudar a los médicos a elegir un tratamiento sobre otro; y revelar dónde un fármaco podría detener una enfermedad sin interferir con otras funciones celulares saludables.
Una nueva visión de la enfermedad.
Mientras que algunos investigadores han estudiado los PPI asociados con mutaciones genéticas individuales, Krogan ha dedicado su carrera a investigarlos a gran escala. «Hay un gran valor en mirar el panorama general», dijo. «Hace que estos análisis sean exponencialmente más poderosos».
Krogan compara los mapas de proteínas con un mapa geográfico generado por computadora. Puede alejar para ver un área grande, luego acercar para ver detalles locales, luego alejar nuevamente para poner ese detalle en contexto.
Ser capaz de ver esos diferentes niveles de detalle puede ayudar potencialmente a los investigadores a identificar medicamentos aprobados por la FDA que podrían probarse para aplicaciones inesperadas, dijo Krogan. «Estos mapas de células son una forma completamente nueva de ver la enfermedad y el descubrimiento de fármacos».
En última instancia, el objetivo de Krogan es permitir que los investigadores apliquen inteligencia artificial a estos mapas, para que puedan predecir el pronóstico de un paciente y la mejor combinación de medicamentos para tratarlo.
«Una vez que entendemos esta biología subyacente, atacar la enfermedad se vuelve mucho más sencillo», dijo Krogan. «Estamos perfectamente posicionados para construir este puente desde el genoma hasta la clínica para una amplia gama de trastornos».
«Estamos en la cúspide de cosas tan grandiosas».
Mirando más allá del ADN para ver el cáncer con nueva claridad
Citación: Navegando del genoma a la clínica usando ‘mapas celulares’ (18 de mayo de 2022) recuperado el 19 de mayo de 2022 de https://medicalxpress.com/news/2022-05-genome-clinic-cell.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.