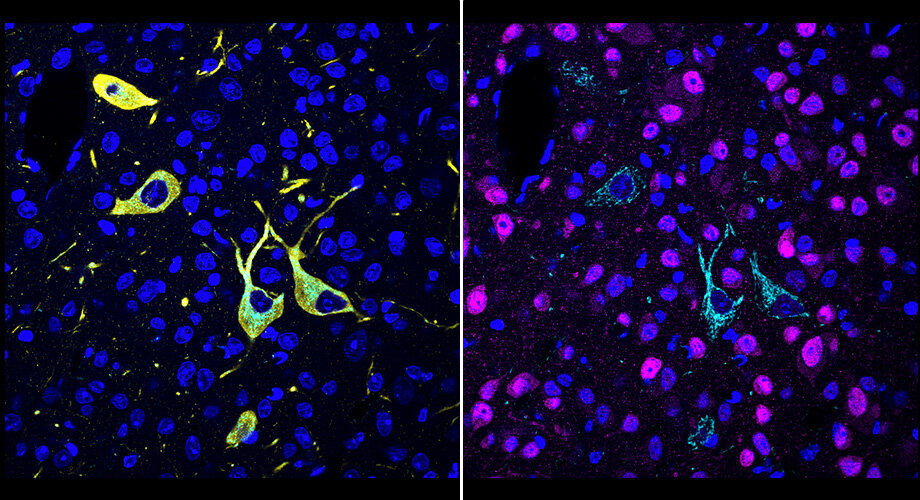
Un equipo de Scripps Research inventó un nuevo método, llamado CATCH, que muestra cómo las drogas alcanzan sus objetivos en el cuerpo. Las células a las que se dirige un fármaco (la pargilina se muestra en cian) se pueden identificar mediante múltiples rondas de inmunomarcaje (el rojo muestra las neuronas; el amarillo muestra las neuronas dopaminérgicas/noradrenérgicas; el azul muestra los núcleos celulares). Crédito: Scripps Research
Los científicos de Scripps Research han inventado una forma de obtener imágenes, a través de diferentes tejidos y con mayor precisión que nunca, donde las drogas se unen a sus objetivos en el cuerpo. El nuevo método podría convertirse en una herramienta de rutina en el desarrollo de fármacos.
Descrito en un artículo en Celúla el 27 de abril de 2022, el nuevo método, llamado CATCH, une etiquetas fluorescentes a moléculas de fármacos y utiliza técnicas químicas para mejorar la señal fluorescente. Los investigadores demostraron el método con varios fármacos experimentales diferentes, revelando dónde, incluso dentro de las células individuales, las moléculas del fármaco alcanzan sus objetivos.
«En última instancia, este método debería permitirnos, por primera vez, ver con relativa facilidad por qué un fármaco es más potente que otro, o por qué uno tiene un efecto secundario particular mientras que otro no», dice el autor principal del estudio, Li Ye, Ph. .D., profesor asistente de neurociencia en Scripps Research y The Abide-Vividion Chair in Chemistry and Chemical Biology.
El primer autor del estudio, Zhengyuan Pang, es un estudiante graduado en el laboratorio Ye. El estudio también fue una estrecha colaboración con el laboratorio de Ben Cravatt, Ph.D., Presidente Gilula de Biología Química en Scripps Research.
«El entorno único en Scripps Research, donde los biólogos trabajan habitualmente junto con los químicos, es lo que hizo posible el desarrollo de esta técnica», dice Ye.
Comprender dónde se unen las moléculas de los fármacos a sus objetivos para ejercer sus efectos terapéuticos (y efectos secundarios) es una parte básica del desarrollo de fármacos. Sin embargo, los estudios de interacción fármaco-diana tradicionalmente han implicado métodos relativamente imprecisos, como los análisis masivos de concentración de molécula de fármaco en órganos completos.
El método CATCH implica la inserción de diminutos mangos químicos en las moléculas del fármaco. Estos identificadores químicos distintos no reaccionan con nada más en el cuerpo, pero permiten la adición de etiquetas fluorescentes después de que las moléculas del fármaco se hayan unido a sus objetivos. En parte porque el tejido humano o animal tiende a difundir y bloquear la luz de estas etiquetas fluorescentes, Ye y su equipo combinaron el proceso de etiquetado con una técnica que hace que el tejido sea relativamente transparente.
En este estudio inicial, los investigadores optimizaron y evaluaron su método para «medicamentos covalentes», que se unen irreversiblemente a sus objetivos con enlaces químicos estables conocidos como enlaces covalentes. Esta irreversibilidad de la unión hace que sea particularmente importante verificar que tales fármacos alcancen sus objetivos previstos.
Los científicos primero evaluaron varios inhibidores covalentes de una enzima en el cerebro llamada amida hidrolasa de ácidos grasos (FAAH). Los inhibidores de FAAH tienen el efecto de aumentar los niveles de moléculas de cannabinoides, incluida la anandamida, la «molécula de la felicidad», y se están investigando como tratamientos para el dolor y los trastornos del estado de ánimo. Los científicos pudieron visualizar, a nivel de una sola célula, dónde estos inhibidores alcanzaron sus objetivos dentro de grandes volúmenes de tejido cerebral de ratón, y pudieron distinguir fácilmente sus diferentes patrones de interacción con el objetivo.
En un experimento, demostraron que un inhibidor experimental de FAAH llamado BIA-10-2474, que causó una muerte y varias lesiones en un ensayo clínico en Francia en 2016, ataca objetivos desconocidos en el cerebro medio de ratones, incluso cuando los ratones carecen de la enzima FAAH —ofreciendo una pista sobre el origen de la toxicidad del inhibidor.
En otras pruebas que demostraron la precisión y versatilidad sin precedentes del nuevo método, los científicos demostraron que podían combinar imágenes de objetivos de fármacos con métodos separados de marcado fluorescente para revelar los tipos de células a las que se une un fármaco. También pudieron distinguir los sitios de compromiso del objetivo de la droga en diferentes partes de las neuronas. Finalmente, pudieron ver cómo las dosis modestamente diferentes de un fármaco a menudo afectan notablemente el grado de compromiso del objetivo en diferentes áreas del cerebro.
El estudio de prueba de principio es solo el comienzo, enfatiza Ye. Él y su equipo planean desarrollar CATCH aún más para su uso en muestras de tejido más gruesas, en última instancia, quizás en ratones completos. Además, planean extender el enfoque básico a fármacos y sondas químicas más comunes, que no se unen covalentemente. En general, dice Ye, visualiza el nuevo método como una herramienta básica no solo para el descubrimiento de fármacos sino también para la biología básica.
«Identificación in situ de dianas de fármacos celulares en tejidos de mamíferos» fue coescrito por Zhengyuan Pang, Michael Schafroth, Daisuke Ogasawara, Yu Wang, Victoria Nudell, Neeraj Lal, Dong Yang, Kristina Wang, Dylan Herbst, Jacquelyn Ha, Carlos Guijas, Jacqueline Blankman, Benjamin Cravatt y Li Ye, todos de Scripps Research durante el estudio.
Un nuevo método para hacer que el tejido sea transparente podría acelerar el estudio de muchas enfermedades
Zhengyuan Pang et al, Identificación in situ de objetivos de fármacos celulares en tejido de mamífero, Celúla (2022). DOI: 10.1016/j.cell.2022.03.040
Citación: Nueva técnica muestra en detalle dónde las moléculas de fármacos alcanzan sus objetivos en el cuerpo (29 de abril de 2022) recuperado el 29 de abril de 2022 de https://phys.org/news/2022-04-technique-drug-molecules-body.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.