Crédito: Metabolismo celular (2024). DOI: 10.1016/j.cmet.2024.09.012
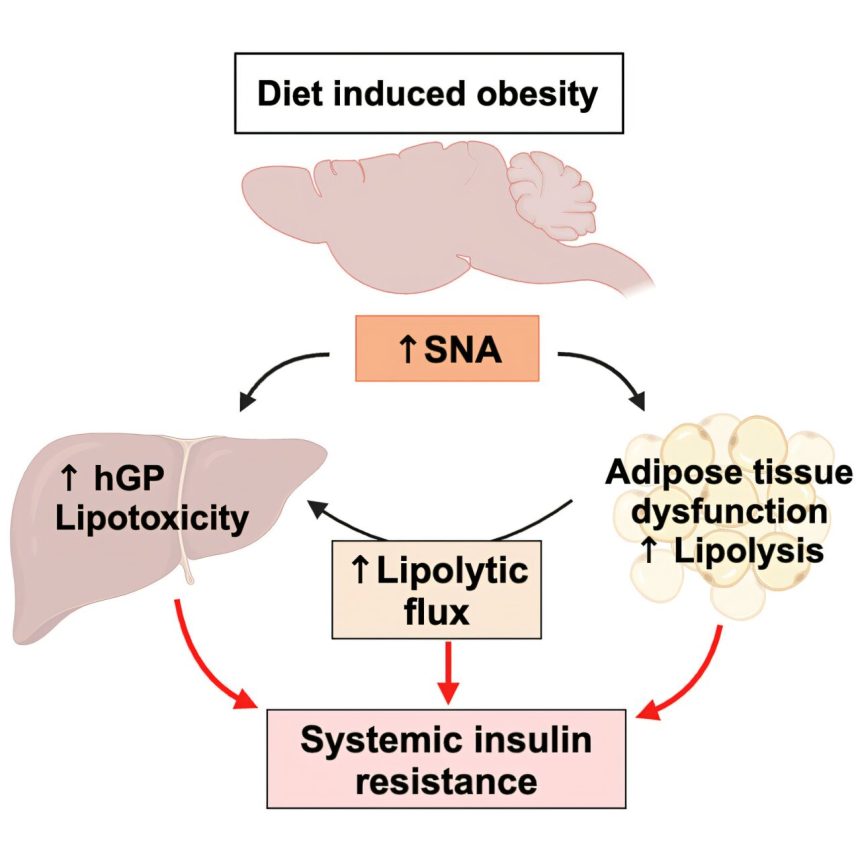
La Facultad de Medicina de Rutgers Robert Wood Johnson y las instituciones colaboradoras han descubierto que la sobrenutrición conduce a resistencia a la insulina y trastornos metabólicos a través del aumento de la actividad del sistema nervioso simpático (SNS). El estudio muestra que reducir la actividad del SNS puede prevenir la resistencia a la insulina inducida por una dieta rica en grasas, lo que sugiere una nueva comprensión de cómo la obesidad causa resistencia a la insulina.
La obesidad causa diabetes tipo 2 y enfermedades metabólicas principalmente al inducir resistencia a la insulina. La alteración de la señalización celular de la insulina es el mecanismo más comprendido, pero no siempre acompaña a una alteración de la acción de la insulina, lo que indica que deben estar implicados otros factores.
El papel del SNS en la obesidad es complejo y algo controvertido. Estudios anteriores han informado de un aumento y una disminución de la actividad del SNS en personas obesas.
Se sabe que la sobrenutrición aumenta rápidamente los niveles plasmáticos de norepinefrina (NE), lo que indica una sobreactivación del SNS. Los métodos que miden directamente la actividad del SNS, como los registros nerviosos y el recambio de NE, a menudo informan un aumento de la actividad del SNS en la obesidad.
Por el contrario, los estudios que se centran en las vías de señalización adrenérgica a veces informan respuestas reducidas de catecolaminas, interpretadas como una disminución de la actividad del SNS.
Esta discrepancia puede explicarse por el desarrollo de resistencia a las catecolaminas debido a la sobreactivación simpática crónica, lo que conduce a respuestas fisiológicas disminuidas a pesar de los niveles elevados de NE.
En un estudio titulado «La sobrenutrición causa resistencia a la insulina y trastornos metabólicos a través del aumento de la actividad del sistema nervioso simpático», publicado en Metabolismo celularlos investigadores investigaron los informes contradictorios sobre la actividad del SNS en la obesidad.
Los investigadores utilizaron un modelo de ratón con deleción inducible y restringida periféricamente del gen de la tirosina hidroxilasa (THΔper ratones). La tirosina hidroxilasa es una enzima necesaria para sintetizar catecolaminas, incluida la NE. Al eliminarlo selectivamente en los tejidos periféricos y al mismo tiempo preservar los niveles de catecolaminas del sistema nervioso central, el modelo permitió el estudio de la actividad periférica aislada del SNS sin afectar las funciones centrales de NE.
Los ratones THΔper y los compañeros de camada de tipo salvaje fueron alimentados con una dieta regular o una dieta alta en grasas (HFD) durante diferentes duraciones para simular la sobrenutrición a corto y largo plazo.
Sobrenutrición a corto plazo
Los ratones de tipo salvaje alimentados con un HFD durante 3 a 10 días mostraron un aumento de grasa corporal, tolerancia a la glucosa y sensibilidad a la insulina alteradas en comparación con los ratones alimentados con comida normal.
A pesar de los niveles elevados de insulina, estos ratones tenían niveles más altos de glucosa en sangre en ayunas y alimentación. La señalización celular de la insulina permaneció intacta en ratones alimentados con HFD, lo que sugiere que se produjo resistencia a la insulina a pesar de las vías normales de señalización de la insulina.
Los ratones de tipo salvaje alimentados con HFD tenían niveles elevados de NE en plasma, lo que indica una mayor actividad del SNS. Hubo una capacidad disminuida de la insulina para suprimir la activación de la lipasa sensible a hormonas en el tejido adiposo blanco, lo que provocó un aumento de la lipólisis y niveles más altos de glicerol en plasma.
Los ratones THΔper alimentados con HFD durante hasta 14 días estuvieron protegidos de la intolerancia a la glucosa y la resistencia a la insulina observadas en ratones de tipo salvaje. Mantuvieron niveles normales de glucosa en ayunas y mostraron una mejora en las pruebas de tolerancia a la glucosa.
Las vías de señalización de la insulina siguieron siendo comparables entre los ratones THΔper y los de tipo salvaje. La mejora de la sensibilidad a la insulina en ratones THΔper fue independiente de cualquier cambio en la señalización celular de la insulina.
Los ratones THΔper mostraron una reducción de más del 90% en los niveles de NE en los tejidos periféricos, sin cambios significativos en los niveles de NE en el cerebro. Mostraron niveles reducidos de glicerol en plasma y una mejor supresión mediada por insulina de la fosforilación de la lipasa sensible a hormonas en los tejidos grasos blancos, lo que indica una mejor regulación de la lipólisis.
La infusión subcutánea de NE durante 14 días en ratones de tipo salvaje alimentados con comida regular aumentó los niveles plasmáticos de NE y alteró la acción de la insulina sin afectar el peso corporal.
Sobrenutrición a largo plazo
Los ratones de tipo salvaje alimentados con un HFD durante 12 semanas mostraron resistencia a las catecolaminas. Los registros nerviosos confirmaron que la actividad del SNS estaba elevada después de 16 semanas de alimentación con HFD en ratones de tipo salvaje. Después de 10 a 12 semanas de alimentación con HFD, estos ratones mostraron intolerancia a la glucosa y niveles elevados de NE, epinefrina y glucagón, lo que indica una mayor activación de los mecanismos que se oponen a la acción de la insulina.
La disfunción del tejido adiposo inducida por HFD en ratones de tipo salvaje se caracterizó por una expresión reducida de enzimas lipogénicas en el tejido adiposo blanco, tamaños de adipocitos más grandes y un aumento de los marcadores de inflamación, fibrosis y senescencia.
Los ratones THΔper fueron protegidos del desarrollo de resistencia a las catecolaminas. Estos ratones tenían niveles plasmáticos de NE significativamente más bajos después de la alimentación con HFD, lo que sugiere una actividad periférica del SNS reducida. Estos ratones continuaron protegidos de la intolerancia a la glucosa a pesar de un aumento de peso y una adiposidad similares en comparación con los ratones de tipo salvaje. Los ratones THΔper tenían niveles plasmáticos significativamente más bajos de NE, epinefrina y glucagón después de la alimentación con HFD, lo que indica una activación reducida de estas hormonas contrarreguladoras.
Los ratones THΔper estaban protegidos de la disfunción del tejido adiposo inducida por HFD. Mantuvieron una mayor expresión de enzimas lipogénicas en el tejido adiposo blanco, tenían adipocitos de menor tamaño y exhibieron marcadores reducidos de inflamación, fibrosis y senescencia.
Los investigadores sugieren que su estudio es un cambio de paradigma en la comprensión de la resistencia a la insulina inducida por la obesidad. La sobreactivación del SNS, en lugar de la alteración de la señalización celular de la insulina, fue el principal factor que llevó a los ratones a obtener o evitar la resistencia a la insulina.
Las implicaciones para la prevención y el tratamiento de la diabetes tipo 2 podrían ser de gran alcance. Como ocurre con cualquier buena investigación que nos dice algo que no sabíamos antes, se necesita más investigación para ver cuántas cosas nuevas podemos aprender de ella.
Más información:
Kenichi Sakamoto et al, La sobrenutrición causa resistencia a la insulina y trastornos metabólicos a través del aumento de la actividad del sistema nervioso simpático. Metabolismo celular (2024). DOI: 10.1016/j.cmet.2024.09.012
© 2024 Red Ciencia X
Citación: Resistencia a la insulina causada por la sobreactivación del sistema nervioso simpático, según un estudio que cambia el paradigma (2 de noviembre de 2024) recuperado el 3 de noviembre de 2024 de https://medicalxpress.com/news/2024-10-insulin-resistance-sympathetic-nervous -paradigma.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.