Crédito: Naturaleza Química Biología (2024). DOI: 10.1038/s41589-024-01627-z
Las células tumorales a menudo secuestran procesos fisiológicos normales para apoyar su crecimiento, explotando proteínas que están a cargo de funciones celulares esenciales. Por tanto, es importante bloquear la actividad de estas proteínas sólo en las células cancerosas sin afectar sus funciones cruciales en los tejidos sanos. Por esta razón, los enfoques clásicos que utilizan moléculas pequeñas que inducen la inhibición sistémica en todas las células del cuerpo pueden provocar efectos secundarios graves.
Un ejemplo de proteínas esenciales secuestradas por las células cancerosas son las catepsinas, una familia de enzimas que se encarga de descomponer otras proteínas y remodelar los tejidos del cuerpo. Las catepsinas están implicadas en diversos cánceres, osteoporosis y enfermedades autoinmunes. Sin embargo, los ensayos clínicos con inhibidores de catepsinas de moléculas pequeñas han fracasado debido a falta de eficacia o toxicidad.
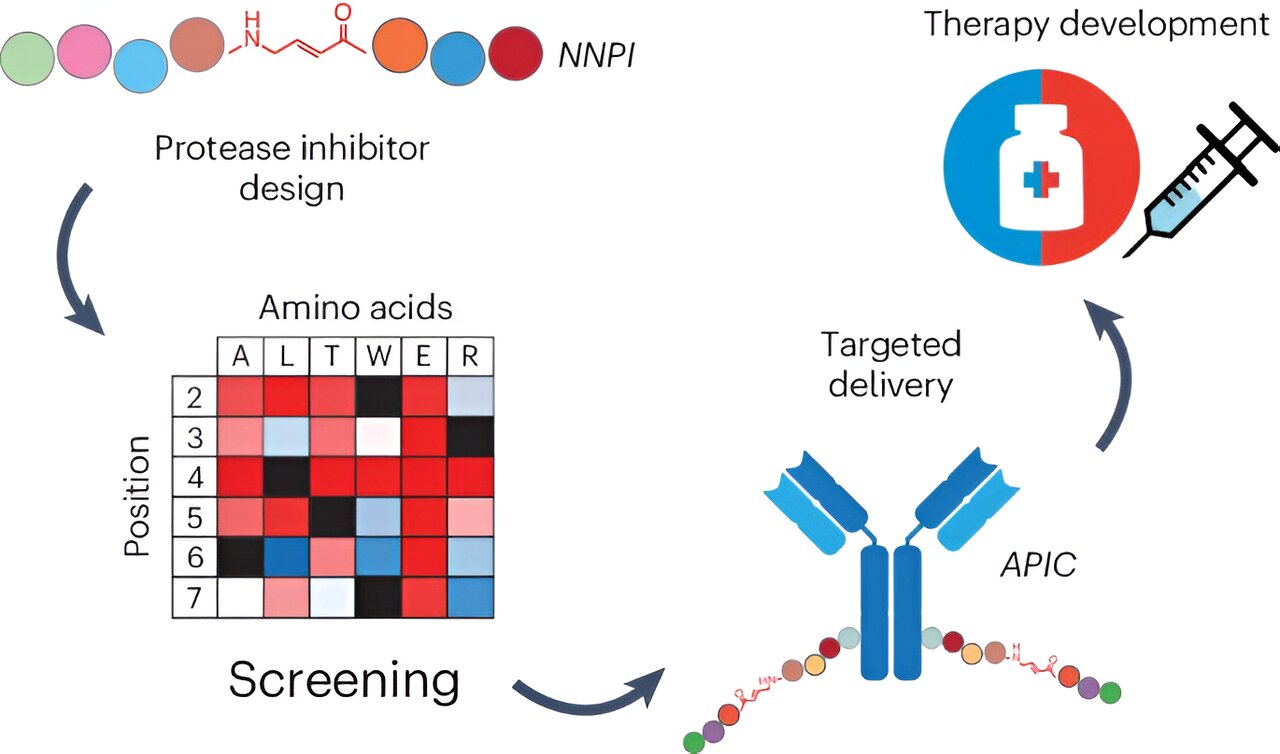
Ahora, un equipo de científicos dirigido por Elisa Oricchio y Bruno Correia de la EPFL ha desarrollado un enfoque novedoso para superar estas limitaciones. Crearon una plataforma modular de fármacos que conjuga inhibidores de péptidos no naturales (NNPI) con anticuerpos, creando conjugados anticuerpo-inhibidor de péptidos (APIC).
Este método garantiza que los inhibidores se administren específicamente a las células cancerosas, reduciendo así los efectos secundarios sistémicos y aumentando la eficacia terapéutica. El estudiar se publica en Naturaleza Química Biología.
Los investigadores comenzaron diseñando NNPI que se unen covalentemente a las catepsinas e las inhiben. Modificaron secuencias peptídicas para incluir un aceptor de Michael, un resto químico que facilita la formación de un enlace estable con catepsinas.
El aceptor de Michael reacciona con el residuo de cisteína en el sitio activo de la catepsina (la parte de la enzima responsable de su trabajo principal), creando un enlace covalente estable que inhibe eficazmente la catepsina. Para optimizar aún más la especificidad y potencia de los péptidos, el equipo utilizó la detección de mutagénesis por saturación, un método que cambia sistemáticamente cada aminoácido en una proteína para encontrar las mejores variantes con las propiedades deseadas.
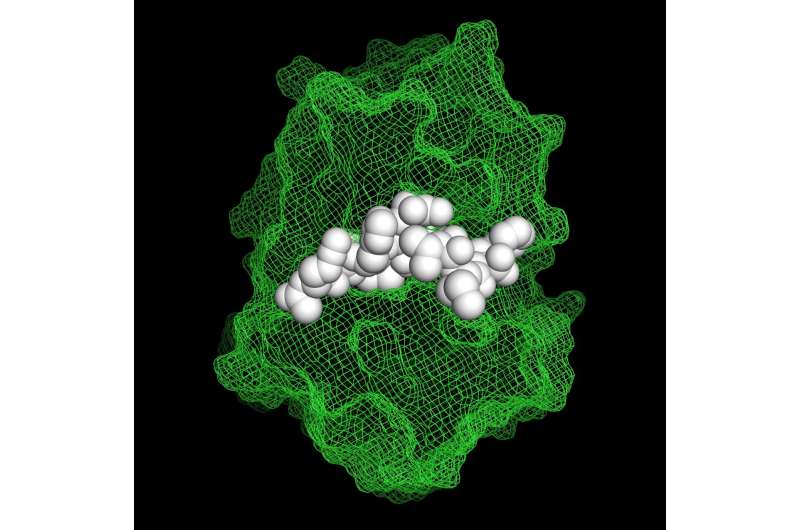
Inhibidor de péptidos no naturales en complejo con catepsina S. Crédito: Aaron Petruzzella (EPFL)
Los investigadores identificaron varios inhibidores potentes contra cuatro catepsinas diferentes, a saber, catepsina S, B, K y L. Al unir estos inhibidores a anticuerpos que reconocen CD22, CD79, HER2 y Siglec15, los investigadores pudieron administrar con precisión los NNPI a las células de linfoma, células cancerosas y osteoclastos. Esto aprovecha la capacidad natural de los anticuerpos para ser internalizados por las células diana, dirigiendo con precisión los inhibidores hacia donde se necesitan.
Entonces llegó el momento de probar los APIC: tanto en líneas celulares como en modelos animales, mostraron efectos terapéuticos significativos. Por ejemplo, en modelos de linfoma, el tratamiento con APIC que se dirigen a la catepsina S condujo a la reducción del tumor y a la activación de la respuesta inmune contra las células cancerosas. En modelos de cáncer de mama, los APIC dirigidos a la catepsina B obstaculizaron la invasividad del tumor y la migración celular, lo que subraya el potencial de los APIC para prevenir la metástasis.
Al administrar inhibidores específicamente a las células cancerosas, el enfoque APIC puede evitar o minimizar los efectos secundarios comúnmente asociados con otros tratamientos, como las quimioterapias. Además, la naturaleza modular del diseño APIC significa que puede adaptarse para apuntar a diversas proteasas implicadas en diferentes enfermedades, revolucionando potencialmente el panorama del tratamiento para afecciones más allá del cáncer.
El proyecto APIC ahora se extiende más allá del laboratorio y está dando sus primeros pasos para convertirse en una realidad clínica. «Hemos presentado dos solicitudes de patente basadas en este proyecto», afirma Elisa Oricchio. «Aaron Petruzzella, el estudiante de doctorado que lideró el proyecto, recibió recientemente el apoyo de la beca SNF Bridge Proof of Concept para continuar trabajando en estos inhibidores, sentar las bases de una startup y atraer la atención de potenciales inversores. «
Más información:
Aaron Petruzzella et al, Los conjugados anticuerpo-péptido administran inhibidores covalentes que bloquean las catepsinas oncogénicas. Naturaleza Química Biología (2024). DOI: 10.1038/s41589-024-01627-z
Citación: Conjugados anticuerpo-inhibidor de péptidos: un nuevo camino para la terapia contra el cáncer (29 de mayo de 2024) obtenido el 29 de mayo de 2024 de https://medicalxpress.com/news/2024-05-antibodypeptide-inhibitor-conjugates-path-cancer.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.