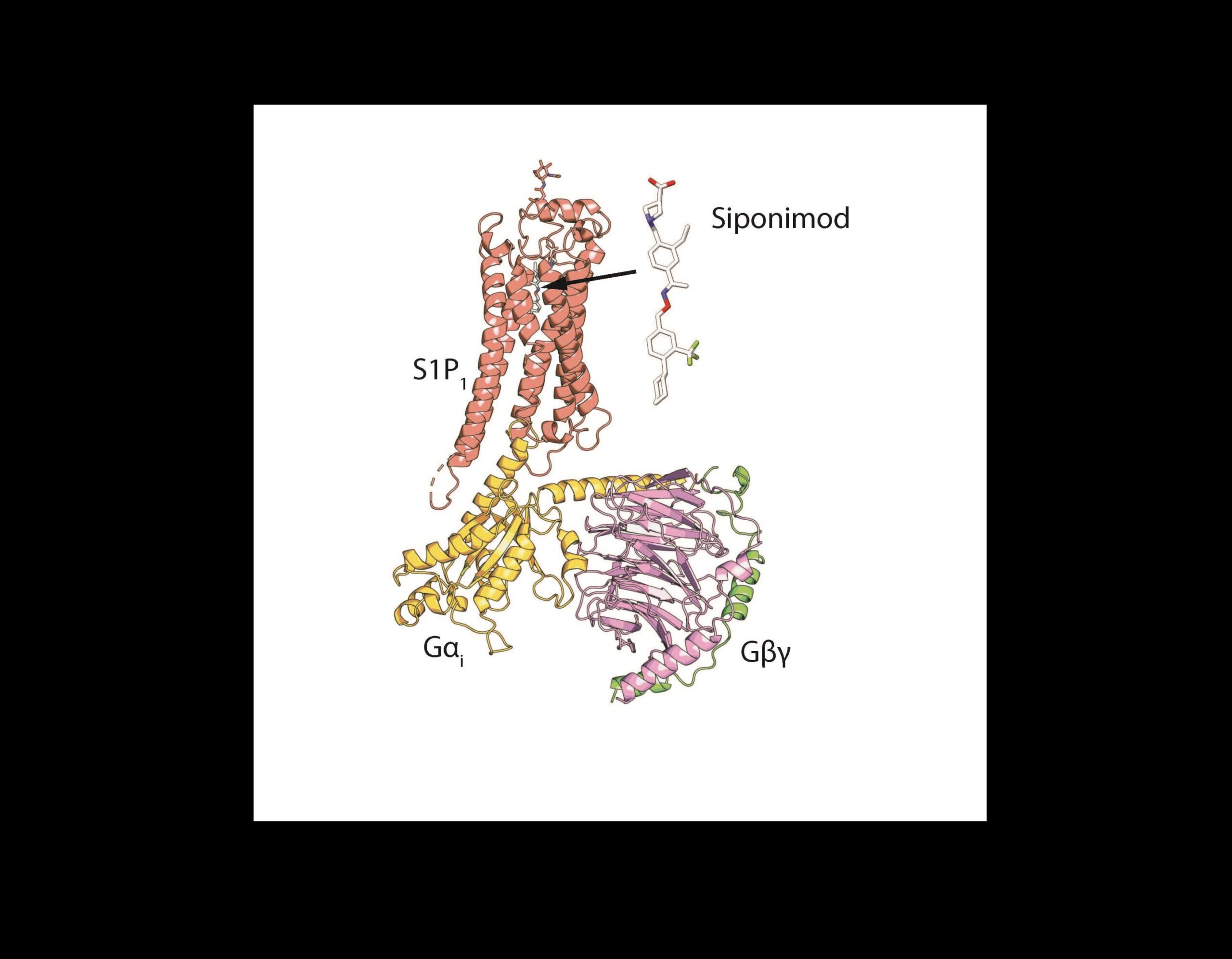
Ilustración de la estructura compleja de S1P1, siponimod y la proteína Gi. La estructura da una idea de cómo el fármaco activa el receptor. Crédito: Dr. Xin-Yun Huang
Investigadores de Weill Cornell Medicine y Memorial Sloan Kettering Cancer Center han descubierto cómo un fármaco para la esclerosis múltiple interactúa con sus objetivos, un hallazgo que puede allanar el camino para mejores tratamientos.
El estudio, publicado el 8 de febrero en Comunicaciones de la naturaleza, detalla la estructura molecular precisa del fármaco para la esclerosis múltiple siponimod a medida que interactúa con su objetivo, el receptor S1P humano 1 (S1P1), y los receptores fuera del objetivo utilizando una técnica de microscopía electrónica de vanguardia llamada crio-EM. Este conocimiento podría ayudar a los científicos a desarrollar medicamentos para la enfermedad que tengan menos probabilidades de fallar en sus objetivos.
«Este descubrimiento nos ayudará a mejorar los medicamentos para la esclerosis múltiple y reducir sus efectos secundarios», dijo el coautor principal del estudio, el Dr. Xin-Yun Huang, profesor de fisiología y biofísica en Weill Cornell Medicine.
En los pacientes con esclerosis múltiple, las células inmunitarias llamadas linfocitos atacan y destruyen la cubierta protectora que rodea las células nerviosas, lo que provoca síntomas neurológicos progresivos. Los científicos desarrollaron medicamentos inmunosupresores que bloquean la liberación de estos linfocitos de los ganglios linfáticos al unirse a los receptores S1P1. Pero la versión de primera generación de estos medicamentos también podría unirse a receptores relacionados, incluido S1P3, lo que provocó efectos secundarios no deseados, incluido un ritmo cardíaco anormal. Para abordar este problema, los científicos crearon medicamentos de próxima generación como siponimod que se unen más selectivamente a S1P1 y otro receptor llamado S1P5. Pero esto no eliminó todos los efectos secundarios no deseados.
El nuevo estudio, codirigido por el Dr. Shian Liu, investigador asociado de Weill Cornell Medicine, y Navid Paknejad, estudiante graduado de Memorial Sloan Kettering, revela cómo el siponimod se une a estos dos receptores y las características de la molécula que lo impiden. de unirse a objetivos no deseados como S1P2, S1P3 y S1P4. Los científicos pueden usar esta información para modificar el fármaco y ayudarlo a adherirse más estrechamente a su objetivo (S1P1) y es menos probable que se una al objetivo no deseado (S1P5), lo que reduce el riesgo de efectos secundarios.
«Esta nueva información estructural nos ayudará a desarrollar la próxima generación de medicamentos para la esclerosis múltiple», dijo el Dr. Huang.
El estudio también ayuda a explicar cómo los lípidos naturales pueden regular el sistema inmunitario, el sistema nervioso y la función pulmonar. El equipo encontró que lípidos casi idénticos llamados esfingosina 1-fosfato y ácido lisofosfatídico asumieron formas muy diferentes cuando se unieron a sus receptores objetivo.
«Los lípidos son moléculas altamente plásticas, y las estructuras revelan cómo los receptores aprovechan las diferencias sutiles en las estructuras de los lípidos para discriminar entre ellos», dijo el coautor principal, el Dr. Richard Hite, biólogo estructural en el Memorial Sloan Kettering y profesor asistente en el bioquímica y biología estructural y los programas de fisiología, biofísica y biología de sistemas en la Escuela de Graduados en Ciencias Médicas de Weill Cornell.
«Esto explica cómo los lípidos pueden desempeñar funciones muy diferentes en el cuerpo a pesar de que sus estructuras químicas son muy similares», dijo el Dr. Huang.
El hallazgo destaca la importancia de diseñar cuidadosamente fármacos basados en lípidos para evitar que no alcancen sus objetivos. «Necesitamos fabricar medicamentos basados en lípidos que sean muy específicos para reducir el riesgo de efectos secundarios», dijo.
Estos nuevos conocimientos pueden ayudar a los científicos a desarrollar mejores tratamientos para otras enfermedades autoinmunes como la enfermedad inflamatoria intestinal, la psoriasis y el lupus sistémico. También podrían ayudar a los científicos a crear terapias basadas en lípidos para afecciones que afectan el cerebro o los pulmones. Por ejemplo, el Dr. Huang señaló que actualmente hay medicamentos a base de lípidos en ensayos clínicos para reducir la rigidez pulmonar en pacientes con COVID-19.
Los efectos metabólicos ‘fuera del objetivo’ de los medicamentos antiinflamatorios utilizados para los trastornos autoinmunes necesitan una mejor estrategia de tratamiento
Shian Liu et al, Mecanismos de activación diferencial de GPCR de lípidos por ácido lisofosfatídico y esfingosina 1-fosfato, Comunicaciones de la naturaleza (2022). DOI: 10.1038/s41467-022-28417-2
Citación: Un nuevo descubrimiento puede ayudar a reducir los efectos secundarios de los medicamentos para la esclerosis múltiple (4 de marzo de 2022) consultado el 5 de marzo de 2022 en https://medicalxpress.com/news/2022-03-discovery-side-effects-multiple-sclerosis.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.