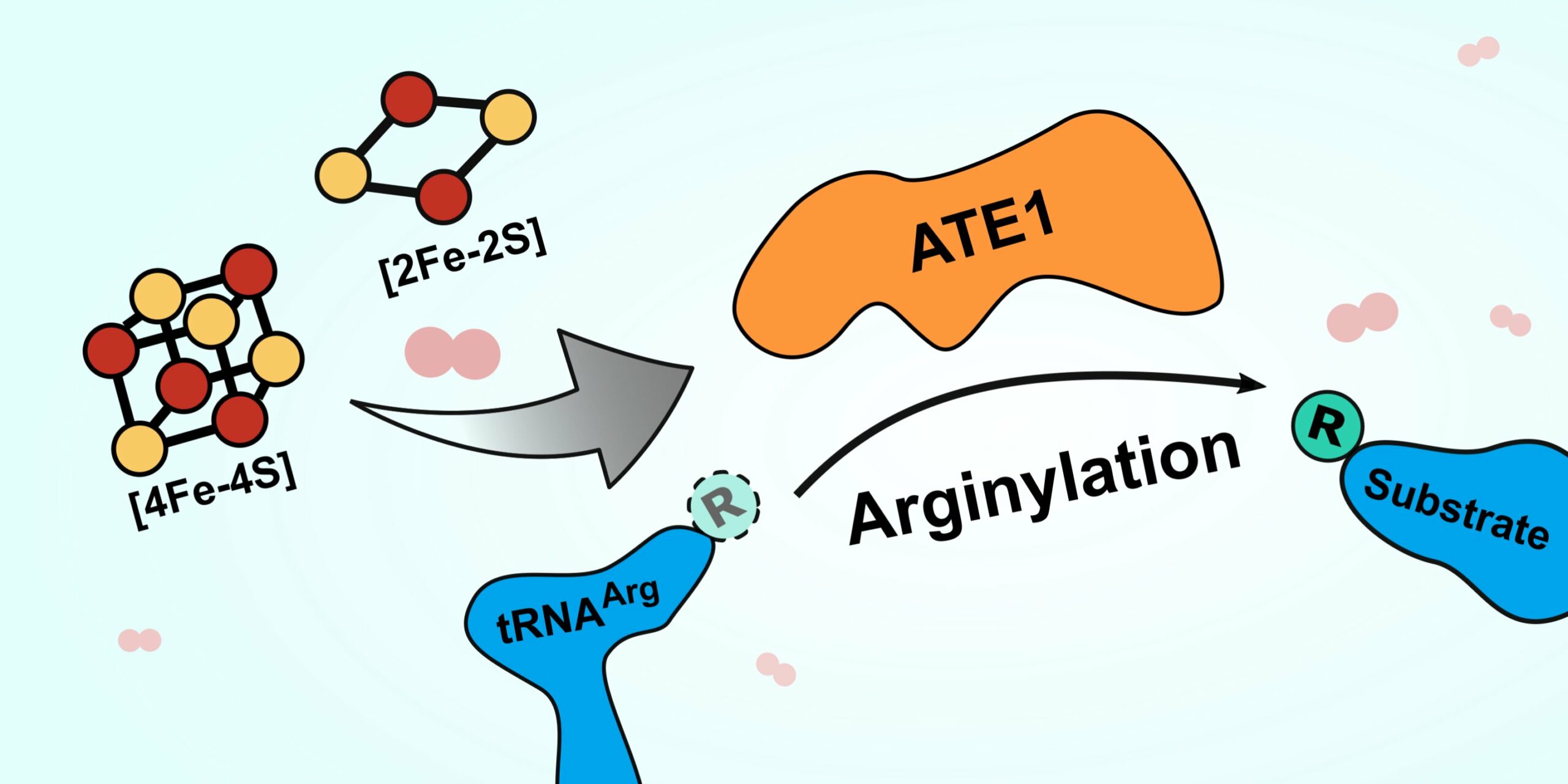
Una ilustración de la función básica de la enzima ATE1. ATE1 efectúa la transferencia de arginina (pequeño círculo verde) de un tRNA (mancha azul, izquierda) a otra proteína (mancha azul, derecha). Un nuevo artículo en Nature Communications encuentra que ATE1 se une a grupos de hierro y azufre (círculos rojos y amarillos a la izquierda), lo que aumenta drásticamente su eficacia. El mismo artículo encontró que ATE1 es sensible al oxígeno, lo que indica que puede moderar la respuesta celular al estrés oxidativo. Crédito: Verna Van
A nuevo papel en Comunicaciones de la naturaleza ilumina cómo funciona una enzima previamente poco conocida en la célula. Muchas enfermedades están relacionadas con el estrés celular crónico, y Aaron T. Smith y sus colegas de la UMBC descubrieron que esta enzima desempeña un papel importante en la respuesta al estrés celular. Una mejor comprensión de cómo funciona y se controla esta enzima podría conducir al descubrimiento de nuevas dianas terapéuticas para estas enfermedades.
La enzima se llama ATE1 y pertenece a una familia de enzimas llamadas arginil-tRNA transferasas. Estas enzimas agregan arginina (un aminoácido) a las proteínas, lo que a menudo marca las proteínas para su destrucción en la célula. Destruir las proteínas que están mal plegadas, a menudo como resultado del estrés celular, es importante para evitar que esas proteínas causen estragos en la función celular. Una acumulación de proteínas que funcionan mal puede causar problemas graves en el cuerpo, lo que lleva a enfermedades como el Alzheimer o el cáncer, por lo que ser capaz de deshacerse de estas proteínas de manera eficiente es clave para la salud a largo plazo.
Implicaciones tentadoras
El nuevo artículo demuestra que ATE1 se une a grupos de iones de hierro y azufre, y que la actividad de la enzima aumenta de dos a tres veces cuando se une a uno de estos grupos de hierro y azufre. Además, cuando los investigadores bloquearon la capacidad de las células para producir los grupos, la actividad de ATE1 disminuyó drásticamente. También encontraron que ATE1 es muy sensible al oxígeno, lo que creen que se relaciona con su papel en la moderación de la respuesta al estrés de la célula a través de un proceso conocido como estrés oxidativo.
«Estábamos muy entusiasmados con eso, porque tiene muchas implicaciones posteriores muy tentadoras», particularmente relacionadas con el papel de la enzima en la enfermedad, dice Smith, profesor asociado de química y bioquímica.
El laboratorio de Smith trabaja inicialmente con la proteína de levadura, pero también mostró que la versión de ratón de ATE1 se comporta de manera similar. Eso es importante, explica Smith. «Dado que la proteína de levadura y la proteína de ratón se comportan de la misma manera», dice, «hay razones para creer que debido a que la proteína humana es bastante similar a la proteína de ratón, probablemente también se comporte de la misma manera».
Un nuevo enfoque
Antes de que hicieran su gran descubrimiento, Smith y el entonces estudiante de posgrado furgoneta verna, Doctor. ’22, bioquímica y biología molecular, había intentado durante bastante tiempo inducir a ATE1 a unirse con el hemo, un compuesto que contiene hierro y es necesario para unir el oxígeno en la sangre, para confirmar los resultados de otro grupo. No estaba funcionando y se estaban frustrando, admite Smith. Pero un día, mientras Smith preparaba una conferencia sobre proteínas que se unen a grupos de átomos de metal y azufre, se dio cuenta de que las proteínas que estaba a punto de tratar con sus alumnos se parecían a ATE1.
Después de darse cuenta de eso, Smith y Van adoptaron un nuevo enfoque. En el laboratorio, agregaron las materias primas para crear grupos de hierro y azufre a una solución con ATE1, y los resultados mostraron que ATE1 sí unía los grupos. «Esto parece prometedor», recuerda haber pensado Smith. «Estábamos muy emocionados por eso».
El hecho de que la enzima se una a los grupos fue interesante y nuevo, «pero luego también preguntamos si eso afecta la capacidad de la enzima para hacer lo que hace», dice Smith. La respuesta, después de más de un año de experimentos adicionales, fue un rotundo sí. En el proceso, el grupo de Smith también determinó la estructura de ATE1 en la levadura (sin el grupo unido a ella), que publicado en el Revista de Biología Molecular en noviembre de 2022.
Sutil pero significativo
Casi al mismo tiempo, otro grupo también publicó una estructura ATE1 ligeramente diferente. La estructura del otro grupo tenía un ion de zinc (otro metal) unido en lugar del grupo de hierro y azufre. Con el zinc en su lugar, un aminoácido clave se gira unos 60 grados. Puede parecer intrascendente, pero Smith cree que la rotación, que supone que es similar al clúster, es la clave del papel del clúster en la función de ATE1.
El aminoácido rotado está directamente adyacente al lugar donde una proteína interactuaría con ATE1 para modificarse, lo que finalmente lo marcaría para su degradación. Cambiar el ángulo de ese aminoácido cambia la forma de la ubicación en la que la proteína se uniría «muy sutilmente», pero cambia su actividad «más que sutilmente», dice Smith.
Mirando hacia adelante y mirando hacia atrás
A Smith también le gustaría explorar cómo otros metales, además del zinc y el grupo de hierro y azufre, pueden afectar la actividad de la enzima. Además, su laboratorio está trabajando para determinar la estructura de ATE1 en un organismo que no sea levadura y para confirmar la estructura de ATE1 con un enlace de grupo de hierro y azufre.
Todos estos pasos crearán una imagen más clara de cómo funciona ATE1 y cómo se regula en la célula. Smith también dice que cree que las proteínas que hasta ahora no se ha demostrado que se unan a los grupos de hierro y azufre pueden depender de ellos.
Este nuevo documento en realidad se remonta a los primeros días de Smith en UMBC. Siempre ha estado interesado en las modificaciones de proteínas, y la adición de arginina es más inusual. «Siempre es algo que había archivado en mi mente y pensé: ‘Oh, sería realmente interesante comprender mejor cómo funciona'», dice.
Varios años más tarde, su grupo ahora está a la vanguardia del descubrimiento de cómo las modificaciones de la arginina influyen en la función celular y la enfermedad.
Más información:
Verna Van et al, Los grupos de hierro y azufre están involucrados en la arginilación postraduccional, Comunicaciones de la naturaleza (2023). DOI: 10.1038/s41467-023-36158-z
Citación: La enzima ATE1 juega un papel en la respuesta al estrés celular, abriendo la puerta a nuevos objetivos terapéuticos (10 de marzo de 2023) recuperado el 10 de marzo de 2023 de https://phys.org/news/2023-03-enzyme-ate1-plays-role-celular .html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.