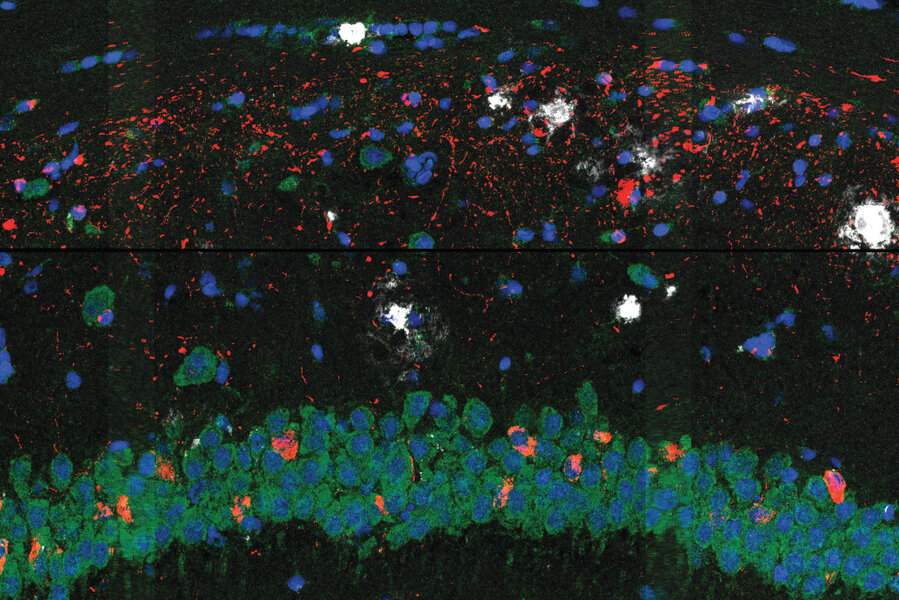
Imagen de microscopía de fluorescencia del tejido cerebral de un modelo de Alzheimer, que muestra ovillos de tau (rojo), placas amiloides (blanco), ARN (verde) y núcleos celulares (azul). Crédito: Zeng H, Huang J, Zhou H, et al.
Un signo común de la enfermedad de Alzheimer es la acumulación excesiva de dos tipos de proteínas en el cerebro: marañas de proteínas tau que se acumulan dentro de las células y proteínas amiloide-β que forman placas fuera de las células. Los investigadores no saben cómo se relacionan estos depósitos de proteínas con la otra característica principal de la enfermedad: la muerte de las neuronas en el cerebro.
Un estudio realizado por científicos del Instituto Broad del MIT y Harvard publicado hoy en Neurociencia de la naturaleza sugiere algunas respuestas a esta pregunta. El equipo utilizó un nuevo método que desarrollaron para revelar cómo las células cerebrales ubicadas cerca de estas proteínas cambian a medida que la enfermedad avanza en un modelo de ratón con Alzheimer. La técnica, llamada STARmap PLUS, es la primera en mapear simultáneamente la expresión génica de células individuales y su ubicación, así como la distribución espacial de proteínas específicas en muestras de tejido intacto.
Los investigadores utilizaron su enfoque para estudiar el tejido cerebral del modelo de ratón con Alzheimer en dos etapas diferentes de la enfermedad y con alta resolución espacial. En la etapa anterior, observaron un núcleo central de placa amiloide rodeada por un tipo de célula inmunitaria en el cerebro llamada microglía, que se sabe que desempeña un papel en el Alzheimer. La microglía que estaba más cerca de las placas mostró firmas genéticas que se han relacionado con la neurodegeneración.
Los científicos también encontraron capas externas de otros dos tipos de células cerebrales que surgieron más tarde en la enfermedad. Esta estructura de núcleo y capa y las diferencias en la expresión génica de las células que rodean las proteínas brindan a los científicos una imagen más clara de cómo las células responden a los depósitos de proteínas en el cerebro, conocimientos que algún día podrían ayudar a los científicos a evaluar los tratamientos existentes para el Alzheimer y desarrollar otros nuevos.
«A partir de este tipo de estudios, se puede inferir lo que sucede de una manera mucho más detallada de lo que podría si solo observara las células de muestras de tejido disperso, que ya no tienen su contexto espacial», dijo Morgan Sheng, co- autor principal del estudio, miembro del instituto central y codirector del Centro Stanley para la Investigación Psiquiátrica en el Broad, y profesor de neurociencia en el MIT. «Esta es una nueva dimensión de la transcriptómica, y creo que tendrá un gran impacto».
El estudio se basa en una versión anterior de la técnica llamada STARmap, desarrollada por Xiao Wang, coautor principal del estudio, miembro del instituto central y miembro de Merkin en el Broad, y profesor de química en el MIT.
«Esta es una mejora emocionante en STARmap porque ahora podemos mapear conjuntamente todo el transcriptoma junto con proteínas en las mismas rebanadas de tejido, y muchas enfermedades implican cambios en la localización de proteínas y modificaciones postranscripcionales», dijo Wang.
El proyecto también es una colaboración con científicos de Genentech y fue dirigido por los coautores del Centro Stanley: Hu Zeng, becario postdoctoral; Jiahao Huang, estudiante de posgrado; y Haowen Zhou, investigador visitante.
haciendo un mapa
Para analizar muestras de tejido con STARmap PLUS, el equipo de Wang utilizó sondas moleculares para detectar ARNm específicos y amplificarlos como secuencias de ADN. También usaron anticuerpos para marcar e identificar proteínas específicas. Luego trataron químicamente el tejido para anclar el ADN y las proteínas en sus posiciones nativas dentro de un gel. Finalmente, utilizaron secuenciación e imágenes in situ para crear un mapa tridimensional de las proteínas marcadas, así como la expresión de más de 2700 genes.
Los científicos descubrieron que procesos como la respuesta inflamatoria del cerebro y la diferenciación de células gliales como la microglía estaban relacionados con la progresión de la enfermedad. Aunque otros investigadores habían observado previamente una estructura de núcleo y cubierta alrededor de la placa, los nuevos datos de expresión génica revelaron que la microglía estaba más «activada» para desencadenar una respuesta inflamatoria más cerca de la placa. Los científicos dicen que esto implica que la microglía probablemente se active cerca de las placas, posiblemente reclutando otras células para formar las capas externas que rodean las placas, en lugar de activarse lejos y luego acercarse. Comprender cuándo, dónde y cómo se activa la microglía podría ser una parte importante para descifrar su papel en la enfermedad.
Wang dice que una ventaja clave de STARmap PLUS es que recopila información de expresión tanto de proteínas como de genes de una sola muestra, lo que facilita la alineación y comparación de diferentes tipos de datos en alta resolución. También puede detectar características más pequeñas que las células, lo que ayuda a distinguir las células individuales incluso cuando están densamente agrupadas en el cerebro. STARmap PLUS también es escalable y podría adaptarse para mapear otras proteínas o incluso el transcriptoma completo.
Más allá del alzhéimer
Los investigadores dicen que un próximo paso crucial será utilizar el enfoque para estudiar la progresión de la enfermedad de Alzheimer en muestras de tejido cerebral humano. Esto ayudará a determinar hasta qué punto los cambios celulares que ocurren en modelos de ratón representan procesos en pacientes con Alzheimer.
En modelos animales, los científicos también podrían usar el enfoque para responder preguntas sobre nuevas estrategias de tratamiento. Por ejemplo, si los anticuerpos pueden alcanzar y eliminar las placas, ¿la microglía cercana vuelve a su estado inactivo y se aleja de las placas? ¿La eliminación de la placa o la inactivación de la microglía previenen la neurodegeneración cercana?
STARmap PLUS también podría ayudar a los investigadores a comprender otras enfermedades, como el cáncer, para obtener más información, por ejemplo, sobre cómo las células inmunitarias atacan los tumores. El método también podría contribuir a los estudios sobre la esquizofrenia y otros trastornos cerebrales.
«Hay modelos de psiquiatría en ratones, donde sabemos por otros estudios que suceden muchas cosas diferentes en diferentes partes del cerebro», dijo Sheng. «Será maravilloso poder verlo todo de una sola vez».
Más información:
Hu Zeng et al, Mapeo integrado in situ de estados transcripcionales de una sola célula e histopatología tisular en un modelo de ratón de la enfermedad de Alzheimer, Neurociencia de la naturaleza (2023). DOI: 10.1038/s41593-022-01251-x
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre investigación, innovación y enseñanza del MIT.
Citación: Los investigadores mapean los cambios de las células cerebrales en la enfermedad de Alzheimer (2 de febrero de 2023) recuperado el 2 de febrero de 2023 de https://medicalxpress.com/news/2023-02-brain-cell-alzheimer-disease.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.