La Administración de Drogas y Alimentos de los Estados Unidos (FDA) aprobado recientemente (se abre en una pestaña nueva) el segundo fármaco en una nueva clase de medicamentos diseñados para tratar enfermedad de alzheimer.
El medicamento, lecanemab (nombre de marca Leqembi), se sometió a una «aprobación acelerada», que difiere del proceso de aprobación estándar de la FDA en el que los fabricantes de medicamentos deben proporcionar evidencia directa del beneficio clínico de un medicamento. Dicho esto, los ensayos de última etapa sugieren que lecanemab reduce ligeramente la tasa de deterioro cognitivo cuando se toma en las primeras etapas de la enfermedad.
Aunque a veces se anuncia como un «gran avance» en Noticias (se abre en una pestaña nueva) cobertura (se abre en una pestaña nueva), lecanemab ha obtenido críticas mixtas de médicos y científicos debido a su modesta eficacia y posibles efectos secundarios, así como a su precio. WordsSideKick.com preguntó a los expertos qué opinan sobre el lecanemab y qué deben saber los pacientes sobre el tratamiento.
«Algunas personas en el campo ven esto como un momento decisivo», Dr. Michael Greicius (se abre en una pestaña nueva), profesor de neurología en Stanford Medicine, le dijo a WordsSideKick.com en un correo electrónico. «Otros, como yo, no».
Relacionado: El ‘marcapasos’ cerebral para el alzhéimer se muestra prometedor para frenar el declive
¿Cómo funciona el lecanemab?
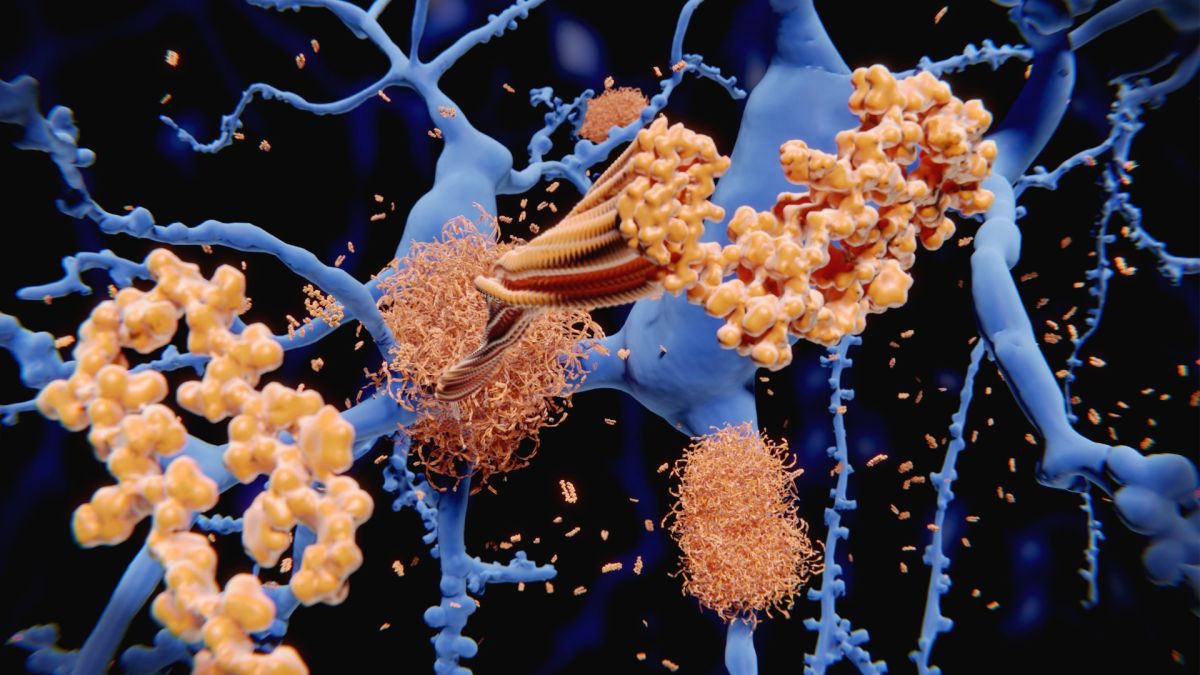
Lecanemab, desarrollado por las compañías farmacéuticas Eisai y Biogen, es un anticuerpo diseñado que se administra por infusión intravenosa. El anticuerpo se adhiere a grupos pegajosos de proteína, llamados placas de beta amiloide, que se acumulan en el cerebro y en el líquido que rodea el cerebro y la médula espinal. Una vez unido, el anticuerpo instruye al sistema inmunitario para destruir esos grumos. Las placas de beta amiloide son un sello distintivo de la enfermedad de Alzheimer y, durante muchos años, la mayoría de los científicos pensaron que estas placas eran la causa principal de la enfermedad.
Los defensores de la llamada hipótesis amiloide teorizan que la acumulación de estas placas desencadena una reacción en cadena que eventualmente mata las células cerebrales involucradas en el pensamiento y la memoria. Esta idea dominó la investigación sobre el Alzheimer durante décadas, pero desde entonces ha sido cuestionada por la evidencia de que las placas amiloides son solo una pieza de un rompecabezas muy complicado, según una revisión de 2018 en la revista. Fronteras en Neurociencia (se abre en una pestaña nueva).
Si bien el debate en torno a la hipótesis del amiloide sigue sin resolverse, la FDA ahora ha aprobado dos medicamentos que apuntan a las placas de beta-amiloide. Otro fármaco de anticuerpos anti-amiloide, aducanumab (nombre comercial Aduhelm), fue aprobado en 2021. La gran pregunta es, ¿ofrecen estos fármacos beneficios claros a los pacientes?
¿Lecanemab es eficaz?
Antes de la aprobación de aducanumab y lecanemab, se aprobaron medicamentos llamados inhibidores de la colinesterasa y antagonistas de NMDA para aliviar algunos de los síntomas cognitivos y conductuales del Alzheimer, según la Instituto Nacional sobre el Envejecimiento (se abre en una pestaña nueva). Estos medicamentos no atacan la raíz de la enfermedad, pero pueden ser útiles para controlar sus efectos.
Aducanumab marcó el primer fármaco «modificador de la enfermedad» aprobado para el Alzheimer, lo que significa que aborda directamente lo que los científicos creen que es la causa de la enfermedad. Pero su aprobación suscitó controversia porque no había pruebas sólidas que sugirieran que retrasaba el deterioro cognitivo, y el comité asesor de la FDA en realidad recomendó que no se aprobara el medicamento, según Naturaleza (se abre en una pestaña nueva).
La FDA aprobó lecanemab sobre la base de un ensayo de etapa intermedia, que mostró que el fármaco eliminó el amiloide, pero no evaluó si desaceleró el deterioro cognitivo. Sin embargo, los resultados de un ensayo más grande en etapa tardía se publicaron en noviembre de 2022 y ofrecen evidencia de que el tratamiento retrasa el deterioro cognitivo «pero evidencia discutible de que tiene un impacto clínico», dijo Dr. Constantino Lyketsos (se abre en una pestaña nueva)la profesora Elizabeth Plank Althouse para la investigación del Alzheimer en la Escuela de Medicina Johns Hopkins.
El ensayo de 18 meses incluyó a unas 1,800 personas con enfermedad de Alzheimer temprana de 50 a 90 años, según un informe del 5 de enero en El diario Nueva Inglaterra de medicina (se abre en una pestaña nueva) (NEJM). La mitad de los participantes recibió infusiones de lecanemab dos veces al mes, mientras que la otra mitad recibió un placebo. El declive cognitivo se rastreó utilizando Clinical Dementia Rating-Sum of Boxes (CDR-SB), una escala de 18 puntos donde los números más altos indican peor demencia. Después de 18 meses, el grupo de lecanemab mostró una disminución significativa de amiloide en el cerebro, en comparación con el grupo de placebo. Mientras tanto, sus puntajes CDR-SB aumentaron 1,21 puntos, mientras que los del grupo placebo aumentaron 1,66 puntos, lo que significa que los puntajes finales diferían en 0,45 puntos.
Los expertos de la industria han argumentado que, «para que un médico note una diferencia en un paciente durante 1 año, el paciente debe disminuir al menos 1 punto completo en el CDR-SB», dijo Greicius. En otras palabras, una diferencia de 0,45 puntos podría no ser perceptible para un médico, y mucho menos para el paciente o sus cuidadores, dijo a WordsSideKick.com.
Dicho esto, dada la duración limitada de los ensayos clínicos, aún no sabemos si los pacientes que toman el medicamento durante más de 18 meses verán beneficios acumulativos o cuál será el curso de la enfermedad después de que los pacientes suspendan el tratamiento, informa el NEJM. señalado.
Cuando los médicos hablan con los pacientes sobre los beneficios potenciales de lecanemab, «realmente se trata de asegurarse de que los pacientes comprendan lo poco que pueden esperar», dijo Lyketsos a WordsSideKick.com. «Hasta que veamos un efecto sólido, creo que la mayoría de la gente optará por no participar».
¿Cuáles son los posibles efectos secundarios de lecanemab?

En el ensayo de última etapa, alrededor del 26 % del grupo de lecanemab tuvo reacciones relacionadas con la infusión, que incluyeron síntomas similares a los de la gripe, náuseas, vómitos y cambios en la presión arterial, en comparación con solo el 7 % del grupo de placebo.
Los participantes del ensayo también experimentaron anomalías en las imágenes relacionadas con el amiloide (ARIA), anomalías estructurales que aparecen en los escáneres cerebrales y que anteriormente se han relacionado con anticuerpos anti-amiloide. Del grupo tratado, el 17 % tenía ARIA con sangrado en o sobre el cerebro, y casi el 13 % tenía ARIA con inflamación cerebral; eso se compara con alrededor del 9 % y el 2 % del grupo de placebo, respectivamente. La mayoría de los casos fueron asintomáticos y se resolvieron por sí solos, aunque a veces las personas informaron síntomas como dolor de cabeza, alteraciones visuales, confusión y mareos.
La FDA exigió que la etiqueta de lecanemab llevara una advertencia sobre este efecto secundario y que los médicos monitorearan de cerca a los pacientes para detectarlo. «ARIA por lo general no tiene síntomas, aunque los eventos graves y potencialmente mortales», como las convulsiones, «rara vez pueden ocurrir», afirmó la FDA.
Cierta evidencia sugiere que tales eventos fatales pueden haber tenido lugar durante la fase de extensión del ensayo, en la que todos los participantes del ensayo pueden optar por tomar el medicamento, de forma abierta, según los documentos obtenidos por ESTADO (se abre en una pestaña nueva) y (se abre en una pestaña nueva) Ciencia (se abre en una pestaña nueva). Estos registros muestran que tres participantes fallecieron por hemorragia cerebral severa, hinchazón y convulsiones después de comenzar a recibir el fármaco durante la fase de extensión; no está claro si estos participantes estaban previamente en el brazo de tratamiento o de placebo del estudio.
Las fuentes le dijeron a STAT y Science que sospechan que las muertes pueden estar relacionadas con ARIA y que el lecanemab, al eliminar el amiloide del cerebro, también puede haber debilitado los vasos sanguíneos de los pacientes. Eisai atribuyó dos de las muertes a factores no relacionados con lecanemab y se negó a comentar sobre la tercera muerte, informó Science en diciembre de 2022. En una declaración escrita a Science, un portavoz de Eisai dijo que «todos los eventos graves, incluidas las muertes», se proporcionan a la FDA y otros organismos reguladores.
En dos de los casos, los anticoagulantes podrían haber empeorado el sangrado de los pacientes, informó Science. «Personalmente, creo que alguien que toma anticoagulantes no debería someterse a estas terapias por ahora», dijo Lyketsos, citando estos casos.
«Creo que ARIA puede ser manejada con bastante seguridad por especialistas en demencia en el entorno estrictamente controlado de un ensayo clínico», dijo Greicius. «Estoy muy preocupado de que si lecanemab llega al mundo real de la práctica clínica, y cuando lo haga, el control de seguridad será, invariablemente, menos riguroso, lo que provocará más muertes de pacientes».
¿Vale la pena el costo de lecanemab?
El curso de un año de lecanemab tendrá un costo estimado de $26,500 por año, aunque el «precio real anualizado puede variar según el paciente», según un declaración (se abre en una pestaña nueva) de Eisai.
«Ese es solo el costo del medicamento», dijo Lyketsos, no el costo de las infusiones reales, los escáneres cerebrales regulares necesarios para detectar ARIA o las pruebas iniciales para confirmar la presencia de placas en el cerebro de un paciente. «Estamos hablando de mucho más [than $26,500]”, dijo Lyketsos.
Y actualmente, Medicare cubre lecanemab solo en el contexto de ensayos clínicos aprobados; la misma política se aplica a aducanumab, según el Centros de Servicios de Medicare y Medicaid (se abre en una pestaña nueva) (CMS).
Esto se debe a que estos medicamentos obtuvieron una aprobación acelerada, que solo requiere que los medicamentos muestren un efecto específico y medible en el cuerpo, no que mejoren un criterio de valoración clínico, como el tiempo hasta la muerte o la discapacidad. Tanto aducanumab como lecanemab eliminan el amiloide del cerebro, pero para obtener una aprobación acelerada, no tenían que demostrar que ayudaron a las personas a mantenerse en forma por más tiempo.
Solo si lecanemab obtiene la aprobación estándar de la FDA, Medicare brindará una cobertura más amplia para el medicamento, afirmó CMS.
Este artículo es solo para fines informativos y no pretende ofrecer consejos médicos.