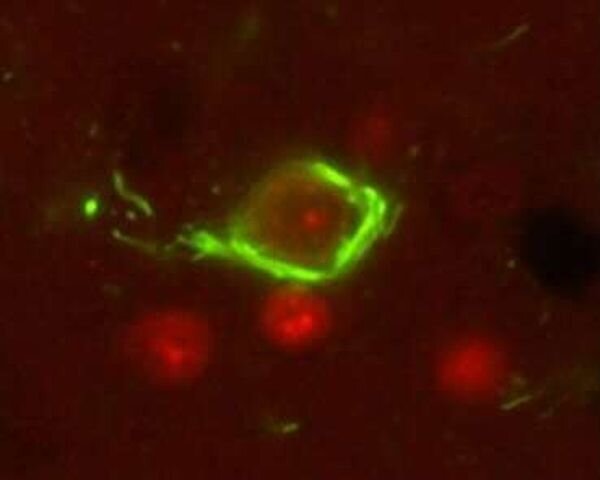
Las proteínas tau defectuosas forman ovillos neurofibrilares insolubles (verde) que provocan la muerte de las neuronas. Crédito: Laboratorio Kraemer
En noviembre, los investigadores informaron que el fármaco lecanemab desaceleró la progresión de la enfermedad de Alzheimer. El efecto fue modesto, pero generó un tremendo entusiasmo porque era la primera vez que se demostraba que un fármaco podía afectar el curso de esta enfermedad implacable e incurable.
El medicamento, lecanemab, es un anticuerpo fabricado que ayuda a eliminar una proteína anormal llamada beta-amiloide, que forma grupos insolubles llamados placas amiloides alrededor de las células cerebrales. Se cree que el amiloide inicia y mantiene la destrucción de las células cerebrales que conduce al deterioro cognitivo y la eventual demencia que aqueja a los pacientes de Alzheimer.
Pero muchos investigadores creen que para que cualquier tratamiento tenga un gran impacto en el curso de la enfermedad de Alzheimer, también tendrán que apuntar a una segunda proteína que hasta la fecha no ha recibido tanta atención como la beta-amiloide, una proteína llamada tau.
«Las placas de amiloide inician la cascada de la enfermedad, por lo que tiene sentido tratar de eliminarlas, pero es la tau la que mata las células», dijo Brian Kraemer, profesor de medicina de la División de Gerontología y Medicina Geriátrica de la Facultad de Medicina de la Universidad de Washington. Medicina.
Kraemer se especializa en enfermedades neurodegenerativas causadas por tau, llamadas tauopatías. Estos incluyen una larga lista de enfermedades neurodegenerativas incurables. En algunos, la tau anormal parece ser la causa principal del trastorno. Estas se denominan tauopatías puras. Incluyen degeneración lobular frontotemporal, parálisis supranuclear progresiva y enfermedad de Pick. Por otro lado, el Alzheimer se denomina tauopatía mixta, porque la beta-amiloide juega un papel.
Tau, que rima con «wow», estabiliza estructuras cruciales dentro de las células, llamadas microtúbulos. Estas estructuras sirven como esqueleto interno de una célula y actúan como conductos a través de los cuales la célula transporta material de un lugar a otro.
En la enfermedad de Alzheimer y otras tauopatías, la tau es defectuosa. Se desprende de los microtúbulos y forma agregados insolubles dentro de las células llamados ovillos neurofibrilares. La descomposición de los microtúbulos y la acumulación de ovillos neurofibrilares interrumpen la capacidad de funcionamiento de las células cerebrales y, finalmente, conducen a la muerte celular.
«Si tuviéramos que apuntar a cualquier cosa en la enfermedad de Alzheimer, probablemente deberíamos apuntar a tau», dijo Kraemer. «Es el más estrechamente relacionado con la disminución de la disfunción cognitiva. Quiere deshacerse del amiloide, pero lo que realmente quiere es preservar la cognición. Eso requiere apuntar a tau».
En un artículo publicado en la revista procedimientos de la Academia Nacional de Ciencias el 26 de diciembre, Kraemer, su equipo y el autor principal Randall Eck, estudiante del Programa de Posgrado en Neurociencia de la UW, informan sobre la identificación de una proteína que parece ser crucial en la formación de colecciones anormales de tau. Los científicos demostraron que bloqueando el gen necesario para la producción de la proteína es posible evitar la acumulación de tau en un modelo animal.
La proteína se denomina proteína POZ de tipo moteado (SPOP). El nombre se refiere a cómo se encuentra en los compartimentos moteados de la célula y al hecho de que contiene un tramo particular de aminoácidos conocido como dominio POZ. Esta es una de varias proteínas que Kraemer y sus colaboradores han relacionado con las tauopatías. Otra proteína, llamada SUT-2 por supresor de tauopatía-2, está siendo explorada por su potencial terapéutico.
El papel exacto que desempeña la proteína en las enfermedades relacionadas con tau no está claro. Pero parece estar involucrado en un proceso esencial por el cual las células manejan y eliminan las proteínas defectuosas. Los hallazgos sugieren que si se pudieran desarrollar fármacos que inhiban el efecto de esta proteína, sería posible tratar la enfermedad de Alzheimer y otras tauopatías.
Para identificar estas proteínas reguladoras clave, Kraemer y sus compañeros de trabajo utilizan un modelo animal creado en su laboratorio hace dos décadas. El modelo es una versión modificada genéticamente de un pequeño gusano, que normalmente se encuentra en el suelo, llamado Caenorhabditis elegans, o C. elegans para abreviar. C. elegans vive solo unas tres semanas, por lo que es ideal para estudiar cómo las mutaciones genéticas afectan el crecimiento, el desarrollo y la función de un organismo a lo largo de su vida.
Para crear el modelo, Kraemer y su equipo introdujeron el gen humano de la proteína tau en los gusanos redondos.
En sus experimentos, los científicos han demostrado que los gusanos alterados desarrollan muchas de las anomalías observadas en las tauopatías humanas: la acumulación de tau insoluble, la muerte progresiva de las células nerviosas, los déficits de comportamiento y la vida útil más corta.
Luego, los investigadores realizaron una evaluación de todos los genes en el gusano para ver si la eliminación aleatoria de alguno de ellos podría prevenir estos cambios. Este enfoque los llevó a identificar primero el gen de SUT-2 y, más recientemente, SPOP.
«Cuando eliminamos la proteína SPOP en nuestro modelo de gusano tau, vemos una disminución dramática en la acumulación de tau y la muerte progresiva de las células nerviosas, así como una mejora en los déficits de comportamiento y la esperanza de vida», dijo Eck.
Kraemer, Eck y otros investigadores en el campo ahora están investigando si sus hallazgos en este modelo de C. elegans pueden traducirse en tratamientos en humanos. El primer paso es ver si la supresión de estos genes puede tener un efecto protector similar en un modelo de ratón de la enfermedad. Los estudios que suprimen el gen de SUT-2 son prometedores y se están realizando estudios que analizan SPOP.
«Todavía estamos en los primeros días del desarrollo de fármacos modificadores de la enfermedad efectivos para el Alzheimer», dijo Kraemer. «Un inhibidor de tau puede ser suficiente para tratar las tauopatías puras, pero para el Alzheimer creo que tendremos que atacar tanto a tau como a amiloide para tener un tratamiento eficaz».
Eck, Randall J. et al, SPOP pérdida de función protege contra la tauopatía, procedimientos de la Academia Nacional de Ciencias (2022). DOI: 10.1073/pnas.2207250120. doi.org/10.1073/pnas.2207250120
Citación: Apuntando a tau, la otra proteína detrás de la enfermedad de Alzheimer (27 de diciembre de 2022) recuperado el 27 de diciembre de 2022 de https://medicalxpress.com/news/2022-12-tau-protein-alzheimer-disease.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.