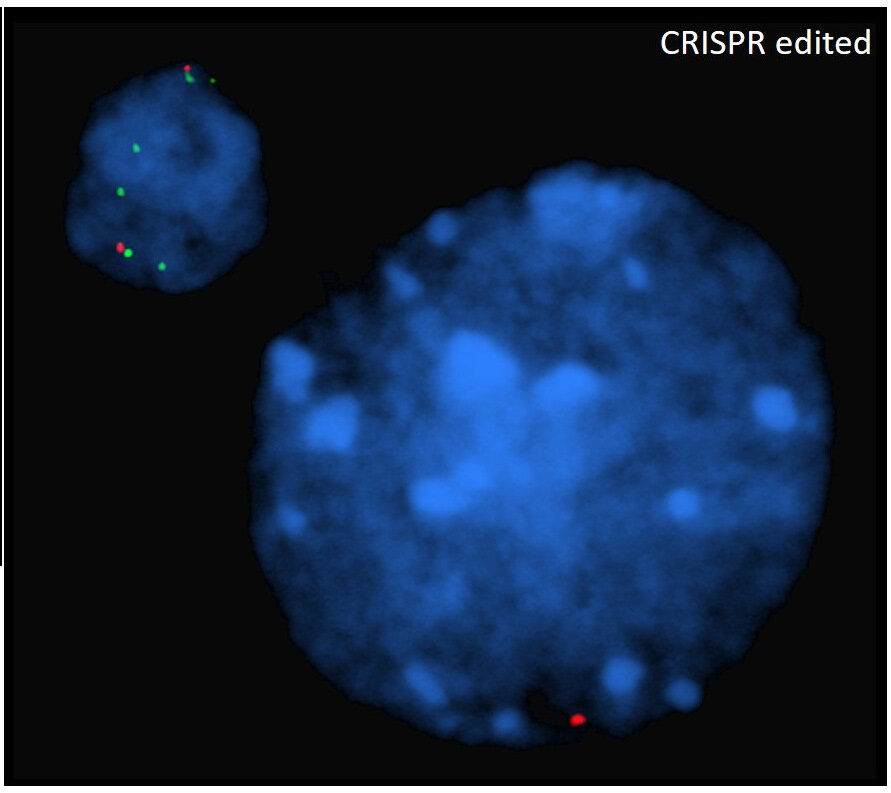
Esto muestra el núcleo que contiene el ADN en una célula madre de los ratones Berkeley. Los puntos verdes y rojos muestran el ADN que ha sido editado por esta nueva terapia génica basada en células madre para la enfermedad de células falciformes. Estos puntos de colores ilustran la ganancia o pérdida anormal de segmentos de ADN después de la edición. Crédito: el laboratorio de Weiss.
La enfermedad de células falciformes es una afección extremadamente debilitante que afecta hasta al 40 % de la población en los países africanos, y los pacientes sufren episodios de dolor insoportable, daños en los órganos y reducción de la esperanza de vida. Esta enfermedad es causada por una mutación en un gen que produce la hemoglobina, la proteína que transporta el oxígeno en los glóbulos rojos, y la hemoglobina dañada distorsiona la forma de los glóbulos rojos, causando obstrucciones dolorosas y potencialmente mortales en los vasos sanguíneos. Sin embargo, los científicos se han dado cuenta de que aumentar la producción de una forma saludable de esta proteína (la hemoglobina fetal, que generalmente solo se produce cuando estamos en el útero), podría proporcionar un tratamiento revolucionario para estos pacientes.
en su actual Modelos y mecanismos de enfermedades artículo, Mitchell Weiss y colegas del St. Jude Children’s Research Hospital, Memphis, EE. UU., han investigado un nuevo tratamiento prometedor que se está desarrollando en el laboratorio de Weiss, y funciona mediante la edición de genes para activar la producción de esta hemoglobina fetal saludable en adultos las células rojas de la sangre. Al probar el tratamiento en ratones, los investigadores descubrieron que, aunque los ratones de laboratorio tenían los síntomas de la enfermedad de células falciformes, el gen de la hemoglobina fetal y el ADN circundante no estaban configurados correctamente, lo que hacía que el revolucionario tratamiento con células madre fuera ineficaz o incluso perjudicial para los animales. , y plantea preocupaciones sobre futuras investigaciones que prueben nuevas terapias basadas en genes en estos ratones de laboratorio.
Antes de que un nuevo tratamiento pueda probarse en personas, los científicos lo prueban en animales de laboratorio, por lo que Weiss y sus colegas probaron su nueva terapia génica en dos tipos de ratones que presentan los síntomas de la enfermedad de células falciformes: los llamados «Berkeley» y «Townes». ratones. Primero, extrajeron las células madre (células en la médula ósea programadas para convertirse en glóbulos rojos) de los ratones y usaron la edición de genes para modificar parte del ADN de las células madre para activar el gen de la hemoglobina fetal saludable. Luego, los científicos volvieron a colocar estas células madre reprogramadas en los ratones y monitorearon a los animales durante 18 semanas para averiguar cómo los afectó el tratamiento.
Sorprendentemente, el 70 % de los ratones Berkeley murió a causa de la terapia, y solo activó la producción del gen curativo de la hemoglobina fetal en el 3,1 % de las células madre de ratón. Por el contrario, el tratamiento experimental activó el gen de la hemoglobina fetal en el 57% de los glóbulos rojos en los ratones Townes y no afectó la supervivencia de los animales. Sin embargo, los niveles de hemoglobina fetal producidos en los glóbulos rojos de los ratones Townes fueron de 7 a 10 veces más bajos que los observados cuando este enfoque se usa en células humanas cultivadas en el laboratorio y no lo suficientemente altos como para reducir los signos clínicos de la enfermedad de células falciformes.
Weiss y sus colegas querían averiguar por qué este nuevo tratamiento no tuvo éxito en los ratones de Berkeley, que se han utilizado durante décadas para probar tratamientos para la enfermedad de células falciformes. El Dr. Weiss dice: «Nos dimos cuenta de que no sabíamos lo suficiente sobre las configuraciones genéticas de estos ratones». Por lo tanto, el equipo secuenció los genes de hemoglobina y el ADN circundante de los ratones de Berkeley y descubrió que en lugar de tener una sola copia del gen humano mutado, los ratones tenían 22 copias rotas dispuestas al azar del gen de la enfermedad de células falciformes humana mutado y 27 copias de la hemoglobina fetal humana que el equipo esperaba activar para curar a los ratones de la enfermedad. Esta composición genética compleja causó los efectos fatales cuando los científicos probaron la terapia génica en los ratones Berkeley, ya que la edición de múltiples copias de un gen puede dañar el ADN. Esto significa que los investigadores no pueden usar estos ratones para probar y optimizar este tratamiento de edición de genes.
Por el contrario, los ratones Townes solo tenían copias individuales del gen de la hemoglobina humana mutada y del gen que produce la hemoglobina fetal humana. Sin embargo, estos ratones probablemente carecían de piezas cruciales de ADN que normalmente regulan la producción del gen de la hemoglobina fetal en humanos. Por lo tanto, no pudieron producir suficiente cantidad de esta proteína saludable para aliviar los síntomas del ratón.
El Dr. Weiss comentó: «Nuestros hallazgos ayudarán a los científicos que usan los ratones Berkeley y Townes a decidir cuál usar para abordar su pregunta de investigación específica relacionada con la enfermedad de células falciformes o la hemoglobina. Además, este trabajo proporciona un recordatorio para que los científicos consideren cuidadosamente la genética de los ratones que están usando para estudiar enfermedades humanas y encontrar el ratón adecuado para el trabajo».
Nuevos conocimientos sobre la maquinaria de los glóbulos rojos ofrecen pistas para tratar la enfermedad de células falciformes
Limitaciones de los modelos de ratón para la enfermedad de células falciformes conferidas por sus configuraciones transgénicas de globina humana, Modelos y mecanismos de enfermedades (2022). DOI: 10.1242/dmm.049463
Citación: Las nuevas terapias génicas para la enfermedad de células falciformes dependen de conseguir el ratón adecuado (6 de julio de 2022) recuperado el 6 de julio de 2022 de https://medicalxpress.com/news/2022-07-sickle-cell-disease-gene-therapies.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.