Las estructuras de ADN extrañamente enredadas y en bucle podrían estar relacionadas con el cáncer, según un nuevo estudio en ratones.
ADN normalmente parece una escalera torcida. Pero la pérdida de enzimas clave en el cuerpo hace que la molécula genética se enrede en bucles y nudos extraños, y al menos en ratones, estas extrañas estructuras de ADN pueden impulsar el desarrollo de cáncer. El científico informó.
En concreto, una familia de enzimas conocidas como enzimas de translocación diez-once (TET) parecen fundamentales para evitar que el ADN forme estos nudos problemáticos, según el estudio, publicado el 22 de diciembre en la revista Inmunología de la naturaleza. Las enzimas TET ponen en marcha un proceso que elimina los grupos metilo, «tapas químicas» que consisten en tres átomos de hidrógeno y uno carbón átomo — de la superficie de las moléculas de ADN. Los grupos metilo evitan que se activen genes específicos dentro del ADN, por lo que, al ayudar a eliminar estos grupos metilo, las enzimas TET desempeñan un papel clave en la regulación de la actividad y el desarrollo de los genes.
Sin embargo, los estudios sugieren que cuando las células no transportan suficientes enzimas TET, esta deficiencia puede contribuir al desarrollo de cáncer. En los glóbulos blancos, en particular, la investigación ha revelado una fuerte correlación entre la falta de enzimas TET y la aparición de cáncer, informó The Scientist.
Relacionado: Genética en números: 10 cuentos tentadores
Para descubrir el motivo de esta correlación, los científicos realizaron un estudio en el que eliminaron dos de las tres enzimas TET de mamíferos, TET2 y TET3, de los glóbulos blancos de los ratones. Usaron modificación genética eliminar los genes para TET2 y TET3 de las células B maduras de los roedores, un tipo de glóbulo blanco. En unas pocas semanas, los ratones desarrollaron linfoma de células B, un cáncer de las células B.
«Resultó parecerse a esta enfermedad humana llamada DLBCL», que significa linfoma difuso de células B grandes, dijo a The Scientist Anjana Rao, autora principal del estudio y bióloga celular y molecular del Instituto de Inmunología de La Jolla en California. Este linfoma en humanos parece originarse en los llamados centros germinales, donde las células T, otro tipo de glóbulos blancos, se juntan con las células B para producir anticuerpos, explicó Rao.
Luego, el equipo se acercó al ADN de estos ratones y descubrió que las moléculas genéticas se habían torcido en formas inusuales.
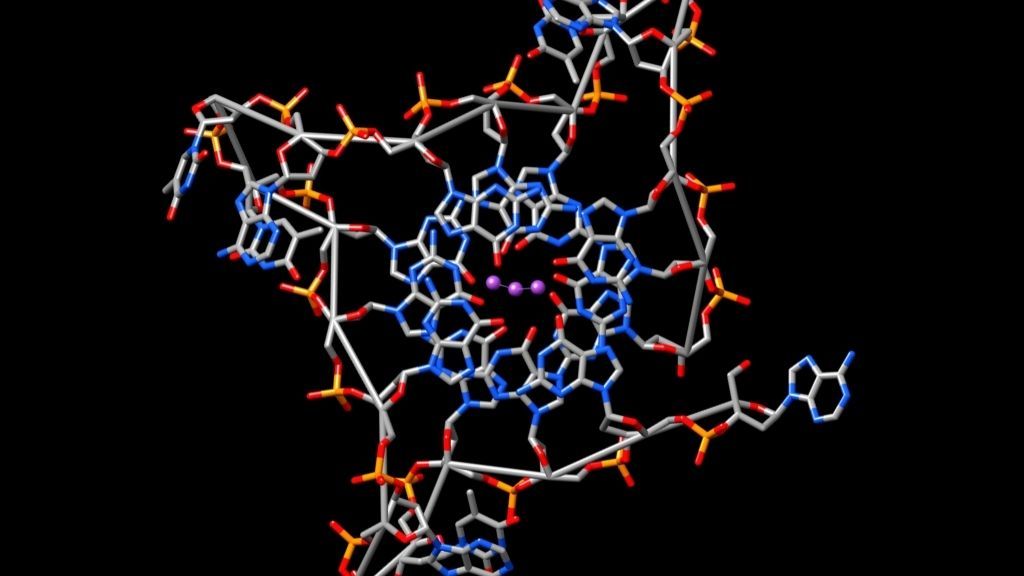
En algunos lugares, el ADN se había plegado en cuádruples G, que se forman cuando una molécula de ADN de doble cadena se pliega sobre sí misma o cuando múltiples cadenas de ADN se unen en una sola guanina, una de las cuatro letras dentro del código genético del ADN. Live Science informó anteriormente. Cuando esto sucede, el ADN adopta la forma de una hélice cuádruple, en lugar de una hélice doble, su clásica estructura de escalera retorcida. Estos extraños nudos de cuatro hilos aparecen en las células cancerosas a tasas mucho más altas que en las células sanas, y se han relacionado con la capacidad de las células cancerosas para dividirse rápidamente, según Live Science.
En otros puntos del ADN de los ratones, otra molécula genética llamada ARN se había deslizado entre los dos lados de la doble hélice del ADN, informaron los investigadores. Estas estructuras enredadas, conocidas como bucles R, interfieren con la replicación del ADN y, por lo tanto, pueden causar inestabilidad genómica que se ha relacionado con el cáncer.
El ADN de los ratones genéticamente modificados (GM) tenía muchos más G-quadruplex y R-loops que el ADN de los ratones no GM, encontró el equipo. Además, en comparación con los ratones no modificados genéticamente, los ratones modificados genéticamente mostraron una actividad amplificada en una enzima llamada DNMT1, que adhiere grupos metilo al ADN. Normalmente, las enzimas TET y DNMT1 se equilibran entre sí, una elimina los grupos metilo y la otra los agrega. Pero en los ratones GM, este equilibrio se rompió, su ADN se enredó y sus células B pronto se volvieron cancerosas.
El nuevo estudio es «uno de los primeros artículos que muestra definitivamente cómo la deficiencia de TET puede causar inestabilidad genómica. Estos G-quadruplex y R-loops van a impulsar esta inestabilidad genómica», Luisa Cimmino, bioquímica de la Universidad de Miami que no participó en el estudio, le dijo a The Scientist. «Esta es una de las primeras pruebas que muestran eso en un modelo de cáncer».
Se necesita más investigación para saber si el modelo de ratón se traduce en humanos, pero si lo hace, podría sugerir nuevas estrategias para tratar los cánceres relacionados con la deficiencia de TET.
Lea más sobre el modelo de ratón en El científico.
Publicado originalmente en Live Science.